ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
Енспрінг®
(Enspryng®)
Склад:
діюча речовина: satralizumab;
1 попередньо наповнений шприц містить 120 мг сатралізумабу;
допоміжні речовини: L-гістидин, L-кислота аспарагінова, L-аргінін, полоксамер 188, вода для ін’єкцій.
Лікарська форма. Розчин для ін’єкцій.
Основні фізико-хімічні властивості: безбарвна або світло-жовтого кольору рідина.
Фармакотерапевтична група. Антинеопластичні та імуномодулюючі засоби. Імуносупресанти. Інгібітори інтерлейкіну. Сатралізумаб.
Код АТХ L04АC19.
Фармакологічні властивості.
Фармакодинаміка.
Механізм дії
Сатралізумаб – гуманізоване IgG2 моноклональне антитіло, що зв’язує розчинний та зв’язаний із мембраною рецептор IЛ-6 людини (IЛ-6Р), перешкоджаючи низхідній передачі сигналу ІЛ-6 через ці рецептори.
IЛ-6 є цитокіном із плейотропними ефектами, що виробляється різними типами клітин і залучений в різні запальні процеси, включаючи активацію B-клітин, диференціацію B-клітин до плазмобластів та вироблення аутоантитіл, активацію та диференціювання Th17-клітин, пригнічення T-регуляторних клітин та зміни проникності гематоенцефалічного бар’єра. Рівень IЛ-6 підвищений в спинномозковій рідині та сироватці крові пацієнтів з оптиконевромієлітом (ОНМ) та хворобами спектра оптиконевромієліту (ХСОНМ) під час періодів активності захворювання. Деякі функції ІЛ-6 залучені в патогенез ОНМ та ХСОНМ, у тому числі вироблення патологічних аутоантитіл до аквапорину-4 (AQP4), білка водних каналів, який в основному експресується астроцитами в ЦНС.
У клінічних дослідженнях застосування препарату Енспрінг® при ОНМ та ХСОНМ спостерігалося зниження рівня С-реактивного білка (CРБ), фібриногену та комплементу (C3, C4 і CH50).
Фармакокінетика.
Фармакокінетика препарату Eнспрінг® вивчалася у здорових добровольців японського походження та здорових добровольців європеоїдної раси, a також у пацієнтів з ОНМ та ХСОНМ. Фармакокінетика (ФК) у пацієнтів з ОНМ та ХСОНМ при застосуванні препарату в рекомендованих дозах була охарактеризована за допомогою популяційного фармакокінетичного аналізу.
Динаміку показника концентрація–час препарату Енспрінг® у пацієнтів з ОНМ та ХСОНМ можна описати за допомогою двокамерної популяційної ФK моделі з паралельною лінійною та мішень-опосередкованою (Міхаеліс – Ментен) елімінацією та підшкірним всмоктуванням першого порядку. Показники кліренсу та об’єму препарату Eнспрінг® алометрично масштабовані за масою тіла (через функцію потужності із фіксованим коефіцієнтом потужності 0,75 та 1 для показників кліренсу та об’єму відповідно). Було показано, що маса тіла є значущою коваріатою, при цьому кліренс та Vc у пацієнтів з масою тіла 123 кг (97,5-й процентиль розподілу маси тіла) збільшувались на 71,3 % і 105 % відповідно порівняно з пацієнтом з масою тіла 60 кг.
Фармакокінетика в рівноважному стані була досягнута після навантажувального періоду (8 тижнів) для Cmin, Cmax та AUC таким чином (середнє [± СВ]): Cmin – 28,5 (10,2) мкг/мл, Cmax – 42,7 (11,9) мкг/мл та AUC – 1020 (313) мкг.мл/добу. На фармакокінетику не впливала фонова імунотерапія (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Абсорбція
Константа швидкості всмоктування препарату Eнспрінг® становила 0,251 у разі застосування 1/добу (95 % ДI: 0,216–0,285), що дорівнювало періоду напівабсорбції приблизно 3 дні при введенні у рекомендованій дозі (див. розділ «Спосіб застосування та дози»). Біодоступність була високою (85,4 %, 95 % ДI: 79,5–95,3 %).
Розподіл
Препарат Eнспрінг® зазнає двофазного розподілу. Центральний об’єм розподілу становив 3,46 л (95 % ДI: 3,21–3,97), периферичний об’єм розподілу становив 2,07 л (95 % ДI: 1,78–2,59). Міжкомпартментний кліренс становив 0,336 л/добу (95 % ДI: 0,261–0,443).
Метаболізм
Метаболізм препарату Eнспрінг® безпосередньо не вивчався. Передбачається, що препарат Енспрінг® елімінується шляхом катаболізму.
Елімінація
Кліренс препарату Eнспрінг® залежить від концентрації. За оцінками, лінійний кліренс становить 0,0601 л/добу (95 % ДI: 0,0524–0,0695) і складає приблизно половину загального кліренсу в рівноважному стані при застосуванні препарату в рекомендованій дозі при ОНМ та ХСОНМ. Асоційований термінальний період напіввиведення (t1/2) становить приблизно 30 днів (діапазон 22–37 днів) на основі об’єднаних даних досліджень ІІІ фази.
Особливі групи пацієнтів
Популяційний фармакокінетичний аналіз у дорослих пацієнтів із ОНМ та ХСОНМ показав, що вік, стать і раса не впливають на фармакокінетику сатралізумабу. Хоча маса тіла впливає на фармакокінетику сатралізумабу, корекція дози не рекомендується при будь-якій з цих демографічних характеристик.
Порушення функції печінки
Формальне дослідження впливу порушення функції печінки на ФK сатралізумабу не проводилось.
Порушення функції нирок
Формальне дослідження впливу порушення функції нирок на ФK сатралізумабу не проводилось, однак 22 пацієнти з легким порушенням функції нирок (кліренс креатиніну < 80 мл/хв і ≥ 50 мл/хв) були включені в клінічні дослідження BN40898 і BN40900. Як очікувалось на основі відомих механізмів кліренсу сатралізумабу, у цих пацієнтів не спостерігалось впливу на ФK і тому корекція дози не потрібна.
Пацієнти літнього віку
Спеціальні дослідження ФK сатралізумабу у пацієнтів віком > 65 років не проводились, однак пацієнти з ОНМ та ХСОНМ віком від 65 до 74 років були включені в клінічні дослідження BN40898 та BN40900.
Популяційний ФK аналіз на основі даних, отриманих у цих пацієнтів, показав, що вік не впливає на ФK сатралізумабу.
Діти
Дані, отримані у 8 дітей (віком 13–17 років), які отримували режим дозування для дорослих, показали, що популяційні ФK параметри сатралізумабу суттєво не відрізняються від таких в дорослій популяції. Тому корекція дози не потрібна.
Клінічні характеристики.
Показання.
Препарат Eнспрінг® показаний як монотерапія або в комбінації з імуносупресивною терапією для лікування хвороб спектра оптиконевромієліту у дорослих та дітей віком від 12 років, у яких виявлені антитіла класу ІgG до аквапорину-4 (тобто у AQP4 ІgG-серопозитивних пацієнтів).
Протипоказання.
Препарат Eнспрінг® протипоказаний пацієнтам із:
- встановленою гіперчутливістю до сатралізумабу або до будь-якої з допоміжних речовин лікарського засобу;
- активним гепатитом В (див. розділ «Особливості застосування»);
- активним або нелікованим латентним туберкульозом (див. розділ «Особливості застосування»).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Формальні дослідження взаємодії інших лікарських засобів з препаратом Енспрінг® не проводились.
Фармакокінетичні взаємодії
Експресія печінкових ферментів CYP450 пригнічується цитокінами, такими як IЛ-6, який стимулює хронічне запалення. Тому експресія CYP450 може змінюватись при пригніченні цитокіну препаратом Енспрінг®.
З цих міркувань на початку та наприкінці терапії препаратом Енспрінг® необхідно спостерігати за пацієнтами, які отримують в індивідуально скоригованих дозах лікарські засоби, що метаболізуються CYP450 3A4, 1A2 або 2C9 (наприклад aторвастатин, блокатори кальцієвих каналів, теофілін, варфарин, фенітоїн, циклоспорин або бензодіазепіни), і за необхідності слід коригувати дозу цих препаратів. З огляду на тривалий період напіввиведення, вплив препарату Енспрінг® на активність ферментів CYP450 може зберігатися протягом кількох тижнів після завершення лікування.
Популяційний фармакокінетичний аналіз не виявив будь-якого впливу азатіоприну, кортикостероїдів чи мофетилу мікофенолату на кліренс препарату Енспрінг®.
Особливості застосування.
Інфекції
У пацієнтів, які отримували лікування антагоністами рецептора IЛ-6, у тому числі препаратом Енспрінг®, спостерігався підвищений ризик інфекцій, включно із серйозними та потенційно летальними інфекціями.
Необхідно відкласти введення препарату Енспрінг® пацієнтам з активною інфекцією, у тому числі із локалізованою інфекцією, до її усунення (див. розділи «Протипоказання», «Спосіб застосування та дози. Відкладене або пропущене введення»). Окрім того, слід розпочати відповідну терапію із додатковим моніторингом у разі серйозних або опортуністичних інфекцій. Слід дотримуватися обережності при лікуванні пацієнтів з рецидивуючими інфекціями або з основними захворюваннями, які підвищують схильність до інфекцій (наприклад, дивертикуліт, цукровий діабет та інтерстиціальна хвороба легень).
Iмуносупресія
Гуморальна імунна відповідь може порушуватись на фоні лікування препаратом Енспрінг®.
Реактивація гепатиту В
Про реактивацію гепатиту B повідомлялось у зв’язку із застосуванням інших імуносупресивних лікарських засобів. Пацієнти з позитивним результатом на гепатит не включались в клінічні дослідження препарату Енспрінг®. Перед початком терапії необхідно виконувати скринінг на ВГС в усіх пацієнтів відповідно до локальних рекомендацій. Пацієнтів з активним гепатитом (тобто з активною інфекцією, підтвердженою позитивними результатами аналізів на HBsAg та антитіла до гепатиту В) не слід лікувати препаратом Енспрінг® (див. розділ «Протипоказання»). Пацієнтів з позитивними результатами серологічного аналізу (тобто негативний результат на HBsAg та позитивний результат на антитіла до ядерного антигену ВГВ [HBcAb+] і позитивний результат на носійство ВГВ [позитивний результат на поверхневий антиген, HBsAg+]) необхідно проконсультувати у гепатолога до початку лікування і моніторувати та лікувати відповідно до локальних медичних стандартів для попередження реактивації гепатиту B.
Tуберкульоз
Туберкульоз виникав у пацієнтів, які отримували лікування іншими антагоністами рецептора IЛ-6. Як рекомендується для інших імуномодулюючих лікарських засобів, перед початком лікування препаратом Енспрінг® усіх пацієнтів необхідно обстежувати на наявність факторів ризику стосовно туберкульозу та наявність латентного туберкульозу. При консультації із інфекціоністом перед початком лікування препаратом Енспрінг® пацієнтів з латентним туберкульозом необхідно пролікувати за допомогою стандартної антимікобактеріальної терапії. Навіть у разі початкового негативного результату аналізу на туберкульоз стан пацієнтів необхідно контролювати щодо ознак та симптомів туберкульозу протягом лікування препаратом Енспрінг®.
Вакцинація
Живі або живі ослаблені вакцини не слід застосовувати одночасно з препаратом Eнспрінг®, оскільки клінічна безпека не встановлена. Інтервал між вакцинацією живими вакцинами та початком терапії препаратом Енспрінг® повинен відповідати сучасним керівництвам з вакцинації при застосуванні імуномодулюючих/iмуносупресивних препаратів.
Відсутні дані щодо ефекту вакцинації у пацієнтів, які отримують препарат Енспрінг®.
Перед початком терапії препаратом Енспрінг® рекомендується інформувати всіх пацієнтів про всі щеплення відповідно до сучасних керівництв щодо імунізації.
Печінкові ферменти
Під час лікування препаратом Енспрінг® спостерігалося підвищення рівня трансаміназ легкого та помірного ступеня. У більшості випадків підвищення рівня трансаміназ становило менше 5 × ВМН, не обмежувало лікування та минало під час лікування препаратом Енспрінг®.
Рівень AЛT та AСT необхідно контролювати кожні 4 тижні протягом перших 3 місяців лікування, потім кожні 3 місяці протягом 1 року і надалі – за клінічними показаннями. Рекомендації щодо припинення лікування див. у розділі «Спосіб застосування та дози. Корекція дози після виникнення небажаних ефектів».
Число нейтрофілів
У результаті лікування препаратом Енспрінг® спостерігалося зменшення числа нейтрофілів. Зменшення числа нейтрофілів 3 і 4 ступеня виникло у 9,6 % пацієнтів на фоні застосування препарату Енспрінг® і у 5,4 % пацієнтів на фоні прийому плацебо (див. розділ «Побічні реакції»).
Число нейтрофілів слід контролювати через 4–8 тижнів після початку лікування і надалі залежно від клінічної ситуації. Рекомендації щодо переривання терапії див. у розділі «Спосіб застосування та дози».
Зловживання лікарськими засобами та залежність
Дослідження зловживання лікарськими засобами та залежності не проводились. Однак відсутні докази, що лікування препаратом Енспрінг® призводить до залежності.
Необхідно дотримуватись обережності при переведенні пацієнта на іншу лікарську форму та/або інший лікарський засіб з тією ж самою діючою речовиною, а також здійснювати належне спостереження за пацієнтом.
Злоякісні новоутворення
Iмуномодулюючі лікарські засоби можуть збільшувати ризик злоякісних новоутворень.
Вплив лікування препаратом Енспрінг® на розвиток злоякісних новоутворень невідомий.
Реакції гіперчутливості
Реакції гіперчутливості можуть виникати у пацієнтів, які отримують лікування біологічними лікарськими засобами. Перед початком лікування пацієнтів необхідно проінформувати про можливі симптоми реакцій гіперчутливості.
Першу ін’єкцію необхідно виконати під наглядом кваліфікованого медичного фахівця.
У разі виникнення реакцій гіперчутливості пацієнту потрібно негайно проінформувати лікаря і, якщо необхідно, звернутися за невідкладною медичною допомогою.
Явища з боку серцево-судинної системи
Інгібітори рецепторів IЛ-6 можуть збільшувати ризик виникнення серцево-судинних захворювань. Зокрема, необхідно здійснювати регулярний моніторинг (ЕКГ, вимірювання артеріального тиску) стану пацієнтів з факторами ризику, такими як артеріальна гіпертензія, дисліпідемія та цукровий діабет.
Показники ліпідного обміну
Підвищення рівня тригліцеридів та холестерину (показники ліпідного обміну) спостерігалось у пацієнтів, які отримували лікування препаратом Енспрінг® (див. розділ «Побічні реакції»). Пацієнтів з підвищеним рівнем показників ліпідного обміну необхідно лікувати відповідно до чинних клінічних рекомендацій з лікування гіперліпідемії.
Активація системи комплементу
Лікування інгібіторами рецепторів ІЛ-6 може призвести до активації системи комплементу. З огляду на попередні клінічні результати, такий ефект не спостерігався при застосуванні препарату Енспрінг®. Однак через обмежені наявні дані такий ризик при застосуванні препарату Eнспрінг® не може бути повністю виключений.
Демієлінізуючі захворювання ЦНС
Під час лікування інгібіторами рецепторів IЛ-6 спостерігалося виникнення інших запальних захворювань ЦНС. Слід звернути увагу на симптоми, які вказують на нове демієлінізуюче захворювання ЦНС. Через обмежені наявні дані такий ризик при застосуванні препарату Eнспрінг® не може бути повністю виключений.
Дивертикул/перфорація кишечнику
Під час лікування інгібіторами рецепторів IЛ-6 пацієнтів з ревматоїдним артритом спостерігалося виникнення дивертикулу та перфорації кишечнику. Пацієнти з дивертикулітом в анамнезі були виключені з основних досліджень препарату Енспрінг®. Підвищений ризик дивертикулу/перфорації кишечнику, який спостерігається при застосуванні інших інгібіторів рецепторів ІЛ-6, не може бути виключений при лікуванні препаратом Енспрінг®. Препарат Eнспрінг® необхідно застосовувати з обережністю пацієнтам з виразкуванням кишечнику або дивертикулітом в анамнезі. У разі виникнення гострого болю в животі слід негайно оглянути пацієнтів з метою раннього виявлення перфорації шлунково-кишкового тракту.
Імуногенність
У дослідженні ІІІ фази BN40898 (у комбінації з імуносупресивною терапією, IСT) і в дослідженні ІІІ фази BN40900 (монотерапія) антитіла до лікарського засобу (ADA) спостерігались відповідно у 41 % та 71 % пацієнтів, які отримували препарат Eнспрінг® в подвійно сліпий період. Здатність цих ADA нейтралізувати зв’язування препарату Енспрінг® невідома.
Експозиція була меншою у ADA-позитивних пацієнтів, однак не спостерігалось впливу ADA на безпеку, а також чіткого впливу на ефективність та фармакодинамічні маркери, що вказують на зв’язування з мішенню.
Лікування сатралізумабом призводило до подібного зниження ризику виникнення підтвердженого рецидиву у пацієнтів в дослідженнях III фази, незважаючи на різну частоту ADA у цих дослідженнях. У пацієнтів з більшою масою тіла та меншою експозицією була вищою ймовірність утворення ADA (незалежно від фонової терапії ІСT), однак лікувальний ефект був порівнянним в усіх групах за масою тіла при застосуванні або в комбінації з IСT, або як монотерапії. Рекомендована доза є прийнятною для усіх пацієнтів, і пацієнтам, у яких утворились ADA, переривання чи модифікація дозування не потрібні.
Застосування у період вагітності або годування груддю.
Застосування під час вагітності
Відсутні дані щодо застосування препарату Енспрінг® вагітним жінкам.
Дослідження на мавпах не показали будь-якого прямого токсичного впливу на вагітність, розвиток плода і постнатальний розвиток. Сатралізумаб проникає через плацентарний бар’єр у тварин. Деякі дані у потомства тварин, які отримували сатралізумаб, можливо, асоціювались з фармакологічним впливом на IЛ-6. Клінічний ефект цього невідомий.
Препарат Eнспрінг® не слід застосовувати під час вагітності, якщо тільки потенційна користь для матері не перевищує потенційний ризик для плода.
Оскільки сатралізумаб перетинає плацентарний бар’єр, у дітей, матері яких отримували Енспрінг®, може бути підвищеним ризик інфекції; слід дотримуватись обережності при застосуванні живих вакцин таким дітям.
Необхідно розглянути питання про застосування відповідного способу контрацепції жінками репродуктивного віку під час лікування та протягом періоду до 5 місяців після введення останньої дози препарату Eнспрінг®.
Застосування під час лактації
Невідомо, чи екскретується препарат Енспрінг® в грудне молоко людини та чи всмоктується у системний кровотік після перорального прийому. Однак, оскільки IgG eкскретуються в грудне молоко людини та існують доклінічні дані щодо екскреції в грудне молоко, жінкам, які отримують лікування препаратом Енспрінг®, не слід годувати груддю. У такому випадку необхідно зіставити користь годування груддю для дитини та користь лікування для матері.
Фертильність
Відсутні клінічні дані щодо впливу препарату Енспрінг® на фертильність людини. Дослідження на тваринах показали відсутність впливу на фертильність самців та самок.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Дослідження впливу на здатність керувати транспортними засобами та працювати з іншими механізмами не проводились. Однак на сьогодні відсутні докази того, що лікування препаратом Енспрінг® впливає на здатність керувати транспортними засобами та працювати з іншими механізмами.
Спосіб застосування та дози.
Загальні рекомендації
З метою забезпечення відстеження біологічних лікарських засобів у медичній документації пацієнта необхідно вказати торговельну назву та номер серії препарату, який вводиться.
Дозування
Препарат Енспрінг® слід вводити у вигляді підшкірної (п/ш) ін’єкції.
Перед початком лікування препаратом Енспрінг® необхідно виконати такі обстеження та аналізи: аналізи на хронічні інфекції, включно зі скринінговим обстеженням на вірус гепатиту B (ВГВ) та туберкульоз, визначення рівня печінкових трансаміназ і білірубіну в сироватці крові та оновлення статусу вакцинації. Щодо пацієнтів, які отримують лікування препаратом Енспрінг®, рекомендується пильність для своєчасного виявлення та діагностики інфекції. Пацієнтів необхідно проінструктувати щодо необхідності раннього звернення за медичною допомогою у разі ознак та симптомів інфекцій з метою своєчасної діагностики інфекцій (див. розділи «Протипоказання», «Особливості застосування»). Пацієнтам необхідно надати пам’ятку для пацієнта.
Початок лікування/навантажувальна доза
Рекомендована навантажувальна доза становить 120 мг у вигляді п/ш ін’єкції кожні 2 тижні (перша доза – в тиждень 0, друга доза – на 2 тижні і третя доза – на 4 тижні) для перших трьох введень.
Підтримуюча терапія
Рекомендована підтримуюча доза становить 120 мг у вигляді п/ш ін’єкції кожні 4 тижні (починаючи з 8 тижня).
Тривалість лікування
Препарат Eнспрінг® призначений для тривалого лікування.
Корекція дози після виникнення небажаних ефектів/взаємодій (див. розділ «Особливості застосування»)
Відхилення рівня печінкових ферментів
Якщо підвищення рівня аланінамінотрансферази (AЛT) чи аспартатамінотрансферази (AСT) становить > 5 × верхньої межі норми (ВМН) і супроводжується підвищенням рівня білірубіну, лікування препаратом Енспрінг® необхідно відмінити і повторне лікування не рекомендується.
Якщо підвищення рівня AЛT або AСT становить > 5 × ВМН і не супроводжується будь-яким підвищенням рівня білірубіну, лікування препаратом Енспрінг® необхідно припинити; його можна відновити (120 мг у вигляді п/ш ін’єкції кожні 4 тижні) після нормалізації рівня AЛT та AСT і з урахуванням оцінки співвідношення користь/ризик лікування для окремого пацієнта. Якщо прийнято рішення про відновлення лікування, необхідно здійснювати ретельний моніторинг параметрів функції печінки, а при будь-якому подальшому підвищенні рівня AЛT/AСT та/або білірубіну лікування препаратом Енспрінг® необхідно відмінити і повторне лікування не рекомендується.
Таблиця 1
Рекомендована доза для відновлення лікування після підвищення рівня печінкових трансаміназ
Час від введення останньої дози | Рекомендована доза для відновлення лікування |
< 12 тижнів | Відновити лікування в дозі 120 мг (підшкірна ін’єкція) кожні 4 тижні. |
≥ 12 тижнів | Відновити лікування в дозі 120 мг (підшкірна ін’єкція) в тиждень 0*, 2 і 4 з наступним введенням по 120 мг кожні 4 тижні. |
* 0 тиждень – час першого введення після пропущеної дози.
Нейтропенія
Якщо число нейтрофілів становить менше 1 × 109/л і це підтверджено при повторних аналізах, лікування препаратом Енспрінг® необхідно перервати до досягнення числа нейтрофілів > 1 × 109/л.
Комбінована терапія
Препарат Eнспрінг® можна застосовувати як монотерапію або в комбінації з будь-яким із зазначених лікарських засобів: пероральні кортикостероїди, aзатіоприн або мікофенолату мофетил. Також див. інструкції для медичного застосування цих лікарських засобів.
Спеціальні інструкції з дозування
Пацієнти з порушенням функції печінки
Безпека та ефективність застосування препарату Енспрінг® пацієнтам з порушенням функції печінки не вивчались (див. розділ «Фармакокінетика. Особливі групи пацієнтів»).
Пацієнти з порушенням функції нирок
Безпека та ефективність застосування препарату Енспрінг® пацієнтам з порушенням функції нирок формально не вивчались, однак, враховуючи, що препарат Енспрінг® є моноклональним антитілом і його кліренс відбувається шляхом катаболізму (а не шляхом ниркової екскреції), не очікується, що буде необхідна корекція дози для пацієнтів з порушенням функції нирок (див. розділ«Фармакокінетика. Особливі групи пацієнтів»). Пацієнти з порушенням функції нирок легкого ступеня були включені в клінічні дослідження, фармакокінетика сатралізумабу у цих пацієнтів залишалась незміненою (див. розділ«Фармакокінетика. Особливі групи пацієнтів»).
Пацієнти літнього віку
Вивчались безпека та ефективність застосування препарату Енспрінг® літнім пацієнтам віком до 74 років. Корекція дози не потрібна пацієнтам віком ≥ 65 років (див. розділ«Фармакокінетика. Особливі групи пацієнтів»).
Безпека та ефективність застосування препарату Енспрінг® літнім пацієнтам віком > 74 років не вивчались (див. розділ«Спосіб застосування та дози. Спеціальні інструкції з дозування»).
Діти
Вивчались безпека та ефективність застосування препарату Енспрінг® обмеженому числу (N = 4) дітей віком ≥ 12 років. Результати щодо фармакокінетики, ефективності та безпеки були порівнянними з такими у дорослих (див. розділ«Фармакокінетика. Особливі групи пацієнтів»).
Безпека та ефективність препарату Енспрінг® при застосуванні дітям віком < 12 років не вивчались.
Відкладене або пропущене введення
Якщо ін’єкцію пропущено з будь-якої причини, крім підвищення рівня печінкових ферментів, її слід виконати відповідно до рекомендацій, наведених в таблиці 2.
Таблиця 2
Рекомендована доза для відкладеного або пропущеного введення
Час від введення останньої дози | Рекомендована доза для відкладеної або пропущеної дози |
< 8 тижнів протягом періоду підтримуючого лікування або пропущеної навантажувальної дози | Виконати підшкірну ін’єкцію дози 120 мг якомога швидше і чекати наступного запланованого введення. Період підтримуючого лікування Після введення відкладеної або пропущеної дози необхідно продовжити введення препарату з частотою кожні 4 тижні. Період введення навантажувальної дози Якщо другу навантажувальну дозу відкладено або пропущено, її слід ввести якомога швидше. Третю та останню навантажувальну дозу необхідно ввести через 2 тижні. Якщо третю навантажувальну дозу відкладено або пропущено, її слід ввести якомога швидше. Першу підтримуючу дозу необхідно ввести через 4 тижні. |
від 8 тижнів до ≤ 12 тижнів | Підшкірна ін’єкція дози 120 мг в тиждень 0* і тиждень 2 з наступним введенням по 120 мг кожні 4 тижні. |
12 тижнів або довше | Підшкірна ін’єкція дози 120 мг в тиждень 0*, 2 і 4 тижні з наступним введенням по 120 мг кожні 4 тижні. |
* 0 тиждень – час першого введення після пропущеної дози.
Режим введення
Першу ін’єкцію необхідно виконати під наглядом кваліфікованого медичного фахівця. Дорослий пацієнт/особа, що доглядає за пацієнтом, можуть здійснювати наступні ін’єкції препарату Енспрінг® вдома за умови, що лікуючий лікар вважатиме це можливим і що дорослий пацієнт/особа, що доглядає за пацієнтом, можуть виконати ін’єкцію.
Пацієнту/особі, що доглядає за пацієнтом, слід негайно звернутися за медичною допомогою, якщо у пацієнта з’являться симптоми серйозних алергічних реакцій, і проконсультуватися зі своїм лікарем, щоб підтвердити можливість продовження лікування препаратом Енспрінг®.
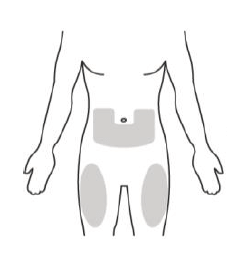
Спосіб застосування
Препарат Eнспрінг® необхідно вводити у вигляді підшкірної ін’єкції. Рекомендованими ділянками для виконання ін’єкції є живіт і стегно. Місця ін’єкцій слід змінювати, а ін’єкції ніколи не можна виконувати у родимки, рубці або вразливі ділянки, ділянки з гематомами, з ознаками почервоніння, ущільнення або пошкодження.
Інструкції щодо поводження
1 попередньо наповнений шприц препарату Eнспрінг® призначений лише для однократного використання.
Перед застосуванням потримайте попередньо наповнений шприц поза картонною упаковкою при кімнатній температурі протягом 30 хвилин.
Не робіть ін’єкцію препарату, якщо рідина непрозора, змінила колір або містить частки.
Перевірте попередньо наповнений шприц та захисний пристрій для голки щодо наявності пошкодження. Не використовуйте препарат, якщо попередньо наповнений шприц та захисний пристрій для голки тріснули або зламані.
Попередньо наповнений шприц з препаратом Eнспрінг®
Перед використанням:
циліндр захисний пристрій активації (не торкатися)

захисний пристрій дата завершення поршень
для голки терміну придатності
Рисунок А
Після використання:

ковпачок голки
(подовжений і заблокований)
Рисунок В
Шприц має захисний пристрій для голки, який автоматично закриває голку, коли ін’єкція закінчена.
Підготовка до застосування препарату Eнспрінг®
1. Вийміть картонну упаковку зі шприцом із холодильника і покладіть на чисту рівну робочу поверхню (наприклад, стіл).
2. Перевірте термін придатності на зворотній стороні упаковки (рисунок C).Незастосовуйтепрепарат, якщо термін придатності, зазначений на упаковці, минув.
3. Переконайтесь, що пломба (голографічна стрічка для контролю відкриття упаковки) на передній частині картонної упаковки все ще ціла (рисунок C).Незастосовуйте препарат, якщо пломба пошкоджена.
Не застосовуйте препарат, якщо термін придатності минув або пломба пошкоджена. У цьому випадку необхідно діяти згідно з рекомендаціями, викладеними у підрозділі «Утилізація препарату Eнспрінг®», та зв’язатись із лікарем.
Рисунок С |
• Перевірте термін придатності (на зворотній стороні картонної упаковки). • Перевірте, чи картонна коробка містить пломбу. |
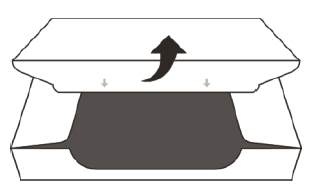
Рисунок D | Відкрийте запломбовану картонну упаковку. |
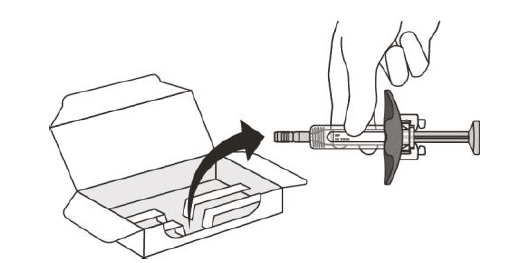
Рисунок Е | Обережно утримуючи шприц за циліндр, дістаньте його з картонної упаковки. • Не перевертайте коробку догори дном, щоб дістати шприц. • Не торкайтесь захисного пристрою активації. Це може пошкодити шприц. • Не тримайте шприц за поршень або захисний пристрій для голки. |
Рисунок F
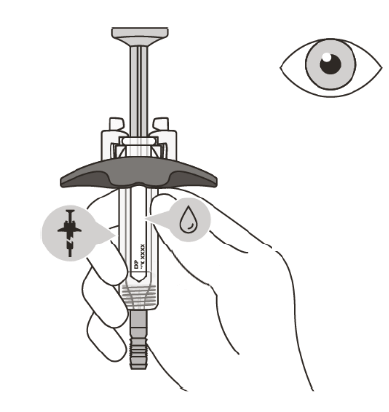
| Огляд шприца Перевірте термін придатності на шприці.Не використовуйте шприц, якщо термін придатності закінчився. Перевірте шприц щодо наявності будь-якого пошкодження.Не використовуйте шприц, якщо є тріщини або дефекти. Перевірте в оглядовому вікні, чи є рідина прозорою та безбарвною або злегка жовтуватою.Не робіть ін’єкцію, якщо рідина помутніла, змінила колір або в ній містяться частинки. Шприц може містити невелику кількість дрібних бульбашок повітря. Це нормально. Не намагайтеся видалити ці бульбашки повітря.
Не застосовуйте препарат, якщо термін придатності минув, шприц пошкоджений або якщо рідина помутніла, змінила колір або в ній містяться частинки. У цьому випадку необхідно діяти згідно з рекомендаціями, викладеними у підрозділі «Утилізація препарату Eнспрінг®», та зв’язатись із лікарем. |
Дозвольте шприцу прогрітися 9. Перевіривши шприц, покладіть його на чисту рівну робочу поверхню (наприклад, стіл) на30 хвилин, щоб він досяг кімнатної температури. Важливо, щоб шприц злегка прогрівся, оскільки введення холодного препарату створює дискомфорт і ускладнює натискання на поршень. Будь ласка, зверніть увагу:
| |
Помийте руки водою з милом. | |
Рисунок G | Виберіть місце ін’єкції:
|
Протріть місце ін’єкції спиртовою серветкою і дайте йому висохнути на повітрі. Будь ласка, зверніть увагу: • Не обдувайте та не дмухайте на ділянку, яку ви очистили. • Не торкайтеся місця ін’єкції знову перед тим, як робити ін’єкцію. | |
Рисунок H | Ін’єкція препарату Енспрінг® Тримайте циліндр шприца між великим і вказівним пальцями. Іншою рукою зніміть ковпачок голки прямо. На кінці голки ви можете побачити краплю рідини, це нормально і не вплине на вашу дозу(рисунок H). |
Будь ласка, зверніть увагу: • Не знімайте ковпачок голки, поки не будете готові ввести препарат Eнспрінг®. • Не надягайте ковпачок голки після її зняття, оскільки це може пошкодити голку. • Не торкайтеся голки і не дозволяйте їй контактувати з іншими поверхнями після зняття ковпачка голки. Негайно утилізуйте ковпачок голки у стійкий до проколів контейнер для гострих предметів. Див. підрозділ «Утилізація препарату Eнспрінг®». | |
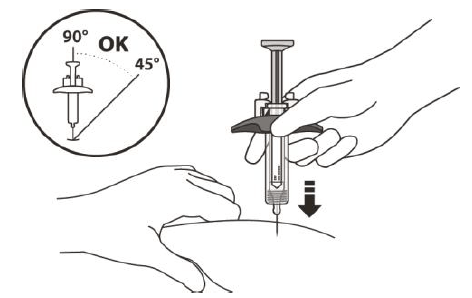
Рисунок I | Тримайте циліндр шприца великим і вказівним пальцями. Іншою рукою зробіть складку з ділянки шкіри, яку ви очистили (рисунок I). Швидким рухом введіть голку під кутом від 45° до 90°(рисунок I). Будь ласка, зверніть увагу: • Не вводьте голку через одяг. • Не змінюйте кут ін’єкції. • Не вводьте голку знову. Після введення голки відпустіть складку шкіри. |
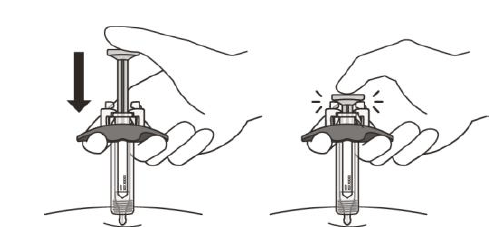
Рисунок J | Повільно введіть увесь препарат, обережно штовхаючи поршень донизу, поки він не торкнеться захисного пристрою активації(рисунок J).
|
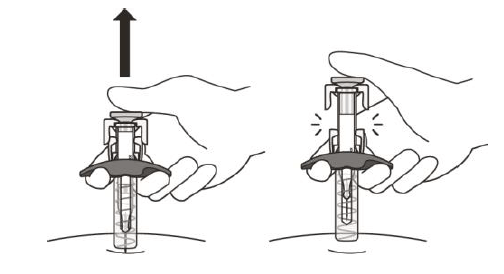
Рисунок К | Обережно відпустіть поршень і дайте голці вийти зі шкіри під тим самим кутом, під яким вона була введена(рисунок К). |
Тепер голка покрита ковпачком голки. Якщо голка не покрита, обережно помістіть шприц у стійкий до проколів контейнер для гострих предметів з метою уникнення травмування, див. підрозділ «Утилізація препарату Eнспрінг®».
Догляд за місцем ін’єкції
У місці ін’єкції може бути невелика кровотеча. На місце ін’єкції можна натиснути ватним диском або марлевою серветкою, але не розтирати його. За необхідності на місце ін’єкції можна наклеїти невеликий пластир. Якщо препарат потрапив на шкіру, промийте ділянку водою.
Утилізація препарату Eнспрінг®
Не намагайтеся повторно закрити шприц. Покладіть використаний шприц у контейнер для утилізації гострих предметів відразу після використання.Не викидайте (не утилізуйте) шприц із побутовими відходами і не переробляйте його.
При використанні та утилізації попередньо наповнених шприців та захисних пристроїв для голки слід суворо дотримуватися таких рекомендацій:
- попередньо наповнений шприц ніколи не слід використовувати повторно,
- покладіть використаний шприц у контейнер для утилізації гострих предметів відразу після використання,
- викиньте (утилізуйте) попередньо наповнений шприц та захисний пристрій для голки відповідно до місцевих вимог або згідно з вказівкою лікаря,
- зберігайте попередньо наповнений шприц, захисний пристрій для голки та всі лікарські засоби в недоступному для дітей місці.
Утилізація невикористаного препарату/препарату із терміном дії, що закінчився
Вивільнення лікарських засобів в навколишнє середовище має бути зведено до мінімуму. Не слід утилізувати лікарські засоби через стічні води, а також потрібно уникати утилізації з побутовими відходами. Використовуйте встановлені системи збору, якщо вони наявні.
Діти
Безпека та ефективність препарату Енспрінг® при застосуванні дітям віком < 12 років не вивчались.
Передозування.
Про випадки передозування у пацієнтів з ОНМ або ХСОНМ не повідомлялось. Відсутній досвід передозування пацієнтів з OНМ або ХСОНМ.
Ознаки та симптоми
Препарат Енспрінг® у разовій дозі до 240 мг вводили підшкірно здоровим дорослим добровольцям у дослідженні I фази, і серйозні або тяжкі небажані явища не спостерігались у цьому дослідженні.
Лікування
При передозуванні слід ретельно спостерігати за пацієнтом і за необхідності призначити симптоматичне лікування та допоміжні заходи.
Побічні реакції.
Резюме профілю безпеки
Безпека препарату Енспрінг® як монотерапії або у комбінації з IСT вивчалась на основі даних, отриманих в двох рандомізованих багатоцентрових подвійно сліпих плацебо-контрольованих клінічних дослідженнях III фази (BN40900 та BN40898) за участю 63 пацієнтів, які отримували препарат Енспрінг® як монотерапію, та 41 пацієнта, які отримували препарат Енспрінг® у комбінації з IСT. Протягом подвійно сліпого контрольованого періоду середня експозиція сатралізумабу у пацієнтів становила близько 2 років в кожному з досліджень BN40900 та BN40898. Середня експозиція плацебо становила близько 1 року.
Найбільш частими побічними реакціями, про які повідомлялось, були головний біль, aртралгія, лейкопенія та реакції, пов’язані з ін’єкцією.
Наявні дані з безпеки обмежені кількістю пацієнтів, які отримували препарат Енспрінг®, а також тривалістю експозиції. Потенційно рідкісні та, можливо, серйозні побічні реакції можуть бути не виявлені в програмі досліджень. Не можна виключити можливі ефекти інгібіторів рецепторів ІЛ-6 як класу, такі як перфорації кишечнику, опортуністичні інфекції, включаючи туберкульоз, реактивацію гепатиту B, підвищений ризик серцево-судинних захворювань, aктивація системи комплементу, демієлінізуючі захворювання і злоякісні новоутворення (див. розділ «Особливості застосування»).
У таблиці нижче узагальнено побічні реакції, про які повідомлялось у зв’язку із застосуванням препарату Енспрінг® як монотерапії або в комбінації з IСT в клінічних дослідженнях. У пацієнтів в групах застосування препарату Енспрінг® в обох клінічних дослідженнях період лікування був довший, ніж в групах плацебо (або плацебо у комбінації з IСT). Побічні реакції, які спостерігалися в клінічних дослідженнях (див. таблицю), зазначені за класами системи органів MedDRA. Відповідна категорія частоти кожної побічної реакції визначена таким чином: дуже часто (≥ 1/10), часто (≥ 1/100 – < 1/10), нечасто (≥ 1/1000 –< 1/100), рідко (≥ 1/10 000 – < 1/1000), дуже рідко (< 1/10 000).
Стисла характеристика побічних реакцій, що виникали у пацієнтів, які отримували препарат Енспрінг® як монотерапію або у комбінації з імуносупресивною терапією в клінічних дослідженнях
Побічні реакції (MedDRA) | Кількість пацієнтів (%) | Категорія частоти для препарату Енспрінг® | |
Eнспрінг® n = 104 | Плацебо1 n = 74 | ||
Iнфекції та інвазії | |||
Інфекції сечовивідних шляхів | 18 (17,3 %) | 15 (20,3 %) | дуже часто |
Інфекції верхніх дихальних шляхів | 20 (19,2 %) | 12 (16,2 %) | дуже часто |
Назофарингіт | 19 (18,3 %) | 8 (10,8 %) | дуже часто |
Грип | 5 (4,8 %) | 6 (8,1 %) | часто |
Розлади з боку нервової системи | |||
Головний біль | 20 (19,2 %) | 8 (10,8 %) | дуже часто |
Miгрень | 4 (3,8 %) | 0 | часто |
Травми, отруєння та ускладнення процедур | |||
Реакції, пов’язані з ін’єкцією | 13 (12,5 %) | 7 (9,5 %) | дуже часто |
Розлади з боку кістково-м’язової та сполучної тканини | |||
Артралгія | 14 (13,5 %) | 1 (1,4 %) | дуже часто |
Кістково-м’язова скутість | 5 (4,8 %) | 0 | часто |
Розлади з боку шкіри та підшкірної клітковини | |||
Висипання | 9 (8,7 %) | 3 (4,1 %) | часто |
Свербіж | 6 (5,8 %) | 1 (1,4 %) | часто |
Психічні розлади | |||
Безсоння | 6 (5,8 %) | 1 (1,4 %) | часто |
Загальні розлади та стани в місці введення | |||
Периферичний набряк | 5 (4,8%) | 0 | часто |
Розлади з боку крові та лімфатичної системи | |||
Гіпофібриногенемія | 3 (2,9 %) | 0 | часто |
Розлади з боку дихальної системи, органів грудної клітки та середостіння | |||
Алергічний риніт | 4 (3,8 %) | 0 | часто |
Розлади обміну речовин та харчування | |||
Гіперліпідемія | 14 (13,5 %) | 9 (12,2 %) | дуже часто |
Розлади з боку крові та лімфатичної системи | |||
Гіпофібриногенемія | 3 (2,9%) | 0 | часто |
Дослідження | |||
Зменшення числа лейкоцитів | 14 (13,5 %) | 4 (5,4 %) | дуже часто |
Підвищення рівня білірубіну в крові | 2 (1,9 %) | 0 | часто |
Збільшення маси тіла | 5 (4,8 %) | 2 (2,7 %) | часто |
Зменшення числа тромбоцитів | 4 (3,8 %) | 2 (2,7 %) | часто |
Підвищення рівня трансаміназ | 7 (6,7 %) | 6 (8,1 %) | часто |
1Плацебо або плацебо у комбінації з IСT.
Опис окремих небажаних ефектів
Реакції, пов’язані з ін’єкцією
Реакції, пов’язані з ін’єкцією, у пацієнтів, які отримували препарат Енспрінг® як монотерапію або у комбінації з IСT, переважно були легкого або середнього ступеня тяжкості, більшість виникала протягом 24 годин після ін’єкцій. Найбільш частими системними симптомами, про які повідомлялось, були діарея та головний біль. Найбільш частими реакціями у місці ін’єкції, про які повідомлялось, були відчуття жару, eритема, свербіж, висипання та біль.
Жодна з реакцій, пов’язаних з ін’єкцією, не потребувала переривання або припинення введення препарату.
Інфекції
З метою коригування у зв’язку з довшою тривалістю лікування в групі сатралізумабу, ніж в групі плацебо, дані щодо інфекцій наведені у випадках на 100 пацієнтороків (випадки, які виникали у 100 пацієнтів через один рік лікування) додатково до відсотків.
У дослідженні монотерапії препаратом Енспрінг® частота інфекцій у пацієнтів, які отримували препарат Енспрінг®, становила 99,8 випадку/100 пацієнтороків (95 % ДI: 82,4–119,8) або 34/63 пацієнтів [54 % (95 % ДI: 40,94 % – 66,61 %)] у порівнянні з пацієнтами, які отримували плацебо [162,6 випадку/100 пацієнто-років (95 % ДI: 125,8–206,9)] або 14/32 пацієнтів [43,8 % (95 % ДI: 26,36 % – 62,34 %)]. Частота серйозних інфекцій становила 5,2 випадку/100 пацієнтороків (95 % ДI: 1,9–11,3) або 6/63 пацієнтів [9,5% (95 % ДI: 3,58 % – 19,59 %)] у пацієнтів, які отримували препарат Енспрінг®, у порівнянні з 9,9 випадку/100 пацієнтороків (95 % ДI: 2,7–25,2) або 3/32 пацієнтів [9,4 % (95 % ДI: 1,98 % – 25,02 %)] у пацієнтів, які отримували плацебо.
У пацієнтів, які отримували препарат Eнспрінг® у комбінації з IСT, частота інфекцій становила 132,5 випадку/100 пацієнтороків (95 % ДI: 108,2–160,5) або 28/41 пацієнтів [68,3 % (95 % ДI: 51,91 % – 81,92 %)] у порівнянні з 149,6 випадку/100 пацієнтороків (95 % ДI: 120,1–184,1) або 26/42 пацієнтів [61,9 % (95 % ДI: 45,64 % – 76,43 %)] у пацієнтів, які отримували плацебо у комбінації з IСT; частота серйозних інфекцій становила 2,6 випадку/100 пацієнтороків (95 % ДI: 0,3–9,2) або 2/41 пацієнтів [4,9 % (95 % ДI: 0,60 % – 16,53 %)] у порівнянні з 5,0 випадку/100 пацієнтороків (95 % ДI: 1,0–14,7) або 3/42 пацієнтів [7,1 % (95 % ДI: 1,50 % – 19,48 %)] у пацієнтів, які отримували плацебо у комбінації з IСT.
Збільшення маси тіла
У подвійно сліпий період лікування збільшення маси тіла ≥ 7 % від вихідного рівня спостерігалось у 26 % пацієнтів, які отримували лікування препаратом Енспрінг® (монотерапія або комбінація з IСT), у порівнянні з 6,8 % пацієнтів, які отримували плацебо (або плюс IСT).
Збільшення маси тіла ≥ 15 % від вихідного рівня спостерігалось у 3,8 % пацієнтів, які отримували лікування препаратом Енспрінг® (монотерапія або комбінація з IСT), у порівнянні з 2,7 % пацієнтів, які отримували плацебо (або плюс IСT).
Відхилення лабораторних показників
Нейтрофіли
У подвійно сліпий період лікування зменшення числа нейтрофілів спостерігалось у 31,7 % пацієнтів, які отримували лікування препаратом Eнспрінг® (монотерапія або комбінація з IСT), у порівнянні з 21,6 % пацієнтів, які отримували плацебо (або плюс IСT). У більшості випадків зменшення числа нейтрофілів було транзиторним або періодичним.
У 9,6 % пацієнтів у групі препарату Енспрінг® рівень нейтрофілів становив менше 1 × 109/л у порівнянні з 5,4 % пацієнтів у групі плацебо або плацебо плюс IСT, що не було асоційовано в часі з будь-якими серйозними інфекціями.
Тромбоцити
У подвійно сліпий період лікування зменшення числа тромбоцитів спостерігалось у 24 % пацієнтів, які отримували лікування препаратом Eнспрінг® (монотерапія або комбінація з IСT), у порівнянні з 9,5 % пацієнтів, які отримували плацебо або плацебо плюс IСT. Зменшення числа тромбоцитів не асоціювалось із кровотечами.
У більшості випадків зменшення числа тромбоцитів було транзиторним і не нижче 75 × 109/л. У жодного пацієнта не спостерігалось зменшення числа тромбоцитів до ≤ 50 × 109/л.
Печінкові ферменти
У подвійно сліпий період лікування підвищення рівня AЛT або AСT спостерігалось у 27,9 % і 18,3 % пацієнтів, які отримували лікування препаратом Eнспрінг® (монотерапія або у комбінації з ІСT, відповідно), у порівнянні з 12,2 % і 13,5 % пацієнтів, які отримували плацебо або плацебо плюс IСT. У більшості випадків підвищення рівня становило менше 3 × ВМН, було транзиторним і зникало без переривання лікування препаратом Енспрінг®.
Підвищення рівня AЛT або AСT > 3 × ВМН спостерігалось у 2,9 % і 1,9 % пацієнтів, які отримували лікування препаратом Eнспрінг® (монотерапія або у комбінації з ІСT, відповідно), що не супроводжувалось підвищенням рівня загального білірубіну. Підвищення рівня AЛT понад 5 × ВМН спостерігалось через 4 тижні після початку лікування у одного пацієнта, який отримував препарат Eнспрінг® у комбінації з IСT, і рівень АЛТ нормалізувався після відміни препарату Енспрінг®.
Параметри ліпідного обміну
У подвійно сліпий період лікування у 10,6 % пацієнтів, які отримували препарат Енспрінг® (монотерапія або комбінація з IСT), спостерігалося підвищення рівня загального холестерину до понад 7,75 ммоль/л у порівнянні з 1,4 % пацієнтів, які отримували плацебо або плацебо плюс IСT; у 20,2 % пацієнтів, які отримували лікування препаратом Eнспрінг®, спостерігалося підвищення рівня тригліцеридів до понад 3,42 ммоль/л у порівнянні з 10,8 % пацієнтів, які отримували плацебо. Підвищення рівня параметрів ліпідного обміну не потребувало переривання введення препарату.
Термін придатності.
2 роки.
Умови зберігання.
Зберігати при температурі від 2 до 8 ºС в оригінальній упаковці з метою захисту від світла.
Не заморожувати. Не струшувати. Зберігати у недоступному для дітей місці. Невідкритий препарат Eнспрінг® можна вийняти з холодильника і повернути його в холодильник у разі необхідності. У разі зберігання при кімнатній температурі загальний комбінований зі зберіганням поза холодильником час не повинен перевищувати 8 днів при температурі не вище 30 ℃.
Упаковка.
Попередньо наповнений шприц об’ємом 1 мл для здійснення підшкірного введення, що складається зі шприца з безбарвного полімеру, що відповідає Фарм. США/Євр. Фарм./Фарм. Японії, з голкою, що не знімається, із нержавіючої сталі, укомплектованої твердим захисним ковпачком із хлорбутилкаучуку та поліпропілену, закупореним обмежувачем ходу поршня із хлорбутилкаучуку, ламінованого фторполімером. По 1 попередньо наповненому шприцу у картонній коробці.
Категорія відпуску.
За рецептом.
Виробник.
Ф.Хоффманн-Ля Рош Лтд
Місцезнаходження виробника та адреса місця провадження його діяльності.
Вурмісвег, 4303 Кайсераугст, Швейцарія