

ІНСТРУКЦІЯ
для медичного застосування лікарського засобу
ФЛЕНОКС®
(FLENOX)
Склад:
діюча речовина: еноксапарин натрію;
1 мл розчину містить: 10000 анти-Ха МО, що еквівалентно 100 мг еноксапарину натрію;
2000 анти-Ха МО/0,2 мл, що еквівалентно еноксапарину натрію 20 мг;
4000 анти-Ха МО/0,4 мл, що еквівалентно еноксапарину натрію 40 мг;
6000 анти-Ха МО/0,6 мл, що еквівалентно еноксапарину натрію 60 мг;
8000 анти-Ха МО/0,8 мл, що еквівалентно еноксапарину натрію 80 мг;
допоміжна речовина: вода для ін’єкцій.
Лікарська форма. Розчин для ін'єкцій.
Основні фізико-хімічні властивості: прозора безбарвна або світло-жовтого кольору рідина.
Фармакотерапевтична група.
Антитромботичні засоби. Група гепарину. Еноксапарини.
Код АТХ В01А В05.
Фармакологічні властивості.
Фармакодинаміка.
Еноксапарин - це низькомолекулярний гепарин (НМГ), у якому розділено антитромботичну та антикоагулянтну активність стандартного гепарину. Він має більш високу анти-Ха активність, ніж анти-IIа, та антитромбінову активність (для еноксапарину співвідношення становить 3,6).
При застосуванні у профілактичних дозах еноксапарин не має значного впливу на аЧТЧ (активований частковий тромбопластиновий час).
При застосуванні лікувальних доз препарату аЧТЧ може бути пролонгований та у 1,5-2,2 раза перевищувати контрольний час максимальної активності. Ця пролонгація відображає залишкову антитромбінову активність.
Лікування гострого інфаркту міокарда з підйомом сегмента ST у комбінації з тромболітичним засобом у хворих, яким проводять подальшу коронарну ангіопластику, а також у хворих, яким цю процедуру не проводять.
У масштабному багатоцентровому клінічному дослідженні 20479 хворих із гострим інфарктом міокарда з підйомом сегмента ST після того, як вони отримали фібринолітичну терапію, були рандомізовані на групи для отримання або еноксапарину у вигляді болюсної внутрішньовенної ін’єкції 3000 анти-Ха МО, слідом за якою негайно підшкірно вводили дозу 100 анти-Ха МО/кг, потім проводили підшкірні ін’єкції по 100 анти-Ха МО/кг кожні 12 годин, або для введення внутрішньовенного нефракціонованого гепарину у вигляді болюсної ін’єкції 60 МО/кг (максимум 4000 МО/кг) з подальшою постійною інфузією у дозі, що була скоригована залежно від показника активованого часткового тромбопластинового часу. Підшкірні ін’єкції еноксапарину проводили до виписки зі стаціонару або не більше 8 днів (у 75 % випадків - не менше 6 днів). Половині хворих, які отримували гепарин, препарат вводили не менше 48 годин (у 89,5 % випадків ≥ 36 годин). Усі хворі також отримували ацетилсаліцилову кислоту протягом не менше 30 днів. Дозу еноксапарину для хворих віком ≥75 років відкоригували: 0,75 мг/кг (75 анти-Ха МО/кг) у вигляді підшкірної ін’єкції кожні 12 годин без початкової болюсної внутрішньовенної ін’єкції.
У ході дослідження 4716 (23 %) хворим було проведено коронарну ангіопластику на тлі антитромботичної терапії із застосуванням замаскованих досліджуваних препаратів. Хворі не отримували додаткові дози, якщо з моменту останньої підшкірної ін’єкції еноксапарину до роздування балона пройшло менше 8 годин, або ж отримували болюсну внутрішньовенну ін’єкцію еноксапарину у дозі 0,3 мг/кг (30 анти-Ха МО/кг), якщо з моменту останньої підшкірної ін’єкції еноксапарину до роздування балона пройшло більше 8 годин.
Еноксапарин дав можливість значно зменшити частоту подій, які відповідають первинним кінцевим точкам (комбінована кінцева точка, що включає рецидив інфаркту міокарда та летальність з будь-якої причини, які були зафіксовані протягом 30-денного періоду спостереження після включення у дослідження: 9,9 % у групі еноксапарину порівняно з 12 % у групі нефракціонованого гепарину (зниження відносного ризику - 17 % (р<0,001)). Частота рецидиву інфаркту міокарда була значно нижча у групі еноксапарину (3,4 % порівняно з 5 %, р<0,001, зниження відносного ризику - 31 %). Летальність була нижча у групі еноксапарину, однак різниця між групами не була статистично достовірною (6,9 % порівняно з 7,5 %, р=0,11).
Перевага еноксапарину з точки зору показника первинної кінцевої точки була беззастережною незалежно від підгрупи (вік, стать, локалізація інфаркту міокарда, діабет або інфаркт міокарда в анамнезі, тип призначеного тромболітика та проміжок часу між появою перших клінічних ознак та початком лікування).
Еноксапарин продемонстрував значну перевагу порівняно з нефракціонованим гепарином з точки зору первинного критерію ефективності як у хворих, які перенесли коронарну ангіопластику у 30-денний період після включення у дослідження (10,8 % порівняно з 13,9 %, 23 % зниження відносного ризику), так і у хворих, яким коронарну ангіопластику не проводили (9,7 % порівняно з 11,4 %, 15 % зниження відносного ризику).
Частота виникнення масивних кровотеч до 30-го дня була достовірно вищою у групі еноксапарину (2,1 %) порівняно з групою гепарину (1,4 %). Частота шлунково-кишкових кровотеч була вища у групі еноксапарину (0,5 %), ніж у групі гепарину (0,1 %), тоді як частота внутрішньочерепних крововиливів в обох групах була однаковою (0,8 % у випадку еноксапарину порівняно з 0,7 % у випадку гепарину).
Аналіз комбінованих критеріїв, за допомогою яких визначали клінічну користь, показав статистично значущу перевагу (р<0,0001) еноксапарину над нефракціонованим гепарином: зниження відносного ризику на 14 % на користь еноксапарину (11 % порівняно з 12,8 %) для комбінованих критеріїв, що включали летальний наслідок, рецидив інфаркту міокарда та тяжку кровотечу (критерії ТІМІ) до 30-го дня, і 17 % (10,1 % порівняно з 12,2 %) для комбінованих критеріїв, що включали летальний наслідок, рецидив інфаркту міокарда та внутрішньочерепний крововилив до 30-го дня.
Фармакокінетика.
Фармакокінетичні параметри препарату оцінюються за змінами анти-Ха та анти-IIа активності у плазмі крові у часі у рекомендованих діапазонах доз.
Біодоступність. При підшкірному введенні еноксапарин всмоктується швидко та практично повністю (майже на 100 %). Максимальна активність у плазмі спостерігається у період між 3-ою та 4-ою годинами після введення.
Ця максимальна активність (виражена у анти-Ха МО) становить 0,18±0,04 (після введення 2000 анти-Ха МО), 0,43±0,11 (після введення 4000 анти-Ха МО) та 1,01±0,14 (після введення 10000 анти-Ха МО).
Болюсна внутрішньовенна ін’єкція 30 мг (0,3 мл; 3000 анти-Ха МО) з подальшими підшкірними ін’єкціями по 1 мг/кг (100 анти-Ха МО/кг) кожні 12 годин призводить до досягнення першого максимального рівня концентрації антифактора Ха, що становить 1,16 МО/мл (n=16), та середнього показника площі під фармакокінетичною кривою, що відповідає 88 % рівноважного рівня. Рівноважний стан досягається на другий день лікування.
У рекомендованому діапазоні доз фармакокінетика еноксапарину є лінійною. Відмінності у показниках в окремого пацієнта та між пацієнтами досить незначні. Після повторного підшкірного введення здоровим добровольцям 40 мг (0,4 мл; 4000 анти-Ха МО) один раз на добу рівноважний стан був досягнутий на 2-й день, при цьому середня активність еноксапарину була майже на 15 % вищою, ніж та, що спостерігалася при одноразовому введенні. Стабільні рівні активності еноксапарину є досить прогнозованими при введенні одноразових доз. Після повторного підшкірного введення 1 мг/кг (100 анти-Ха МО/кг) два рази на добу рівноважний стан був досягнутий у період між 3-ім та 4-им днем, при цьому середня АUС була на 65 % вища, ніж та, що спостерігалася при одноразовому введенні, а максимальна та мінімальна анти-Ха активність становила 1,2 та 0,52 анти-Ха МО/мл відповідно. Відповідно до показників фармакокінетики еноксапарину натрію ця різниця у досягненні рівноважного стану може очікуватися також і для терапевтичного діапазону доз.
Анти-Ха активність у плазмі після підшкірного введення майже у 10 разів нижча, ніж анти-IIа активність. Середня максимальна анти-Ха активність спостерігається приблизно через 3-4 години після підшкірної ін’єкції, досягаючи 0,13 анти-Ха МО/мл після повторного введення дози 1 мг/кг (100 анти-Ха МО/кг) два рази на добу.
Розподіл. Об'єм розподілу еноксапарину натрію за анти-Ха активністю становить приблизно 5 л і майже відповідає об'єму крові, що циркулює.
Метаболізм. Метаболізм еноксапарину відбувається переважно у печінці (шляхом десульфатизації та деполімеризації).
Виведення. Після підшкірної ін'єкції період напіввиведення за анти-Ха активністю у низькомолекулярних гепаринів є більш тривалим порівняно з цим показником у нефракціонованих гепаринів.
Елімінація еноксапарину є монофазною, при цьому період напіввиведення становить приблизно 4 години після одноразового підшкірного введення та майже 7 годин при введенні повторних доз. Для низькомолекулярних гепаринів характерний більш швидкий спад анти-IIа активності у плазмі крові порівняно з анти-Ха активністю.
Еноксапарин та його метаболіти виводяться із сечею (ненасичуваний механізм), а також із жовчю.
Нирковий кліренс речовин з анти-Ха активністю становить 10 % введеної дози, а загальна ниркова екскреція активних та неактивних метаболітів - 40 % дози.
Групи підвищеного ризику
Пацієнти літнього віку.Оскільки у цій віковій категорії спостерігається фізіологічне зниження функції нирок, то елімінація є більш повільною. Це не впливає на дозування або режим введення при профілактичному лікуванні. У пацієнтів віком від 75 років дуже важливо систематично контролювати функцію нирок за допомогою формули Кокрофта перед початком лікування препаратами НМГ.
Пацієнти з легкою та помірною нирковою недостатністю (кліренс креатиніну >30 мл/хв). В окремих випадках може бути корисним проведення моніторингу анти-Ха активності з метою виключення можливості передозування, якщо еноксапарин застосовувати у лікувальних дозах.
Клінічні характеристики.
Показання.
- Профілактика венозної тромбоемболії при хірургічних втручаннях, які супроводжуються помірним та високим тромбогенним ризиком;
- профілактика тромбозу глибоких вен у пацієнтів, які перебувають на постільному режимі у зв’язку з гострими терапевтичними захворюваннями: серцева недостатність ІІІ або ІV класу за класифікацією NYHA, гостра дихальна недостатність, гостре інфекційне або ревматичне захворювання, при наявності принаймні ще одного фактора ризику венозної тромбоемболії;
- профілактика тромбоутворення в екстракорпоральному контурі кровообігу під час проведення гемодіалізу (процедура в середньому триває приблизно до 4 годин);
- лікування діагностованого тромбозу глибоких вен, який супроводжується або не супроводжується тромбоемболією легеневої артерії та не має тяжких клінічних симптомів, за винятком тромбоемболії легеневої артерії, яка вимагає лікування тромболітичним засобом або хірургічного втручання;
- лікування нестабільної стенокардії та гострого інфаркту міокарда без зубця Q у комбінації з ацетилсаліциловою кислотою;
- лікування гострого інфаркту міокарда з підйомом/елевацією сегмента ST у комбінації з тромболітичним засобом у хворих, яким можливе подальше застосування коронарної ангіопластики, а також у хворих, яким цю процедуру не проводять.
Протипоказання.
Для доз 2000 анти-Ха МО/ 0,2 мл, що еквівалентно еноксапарину натрію 20 мг;
4000 анти-Ха МО/0,4 мл, що еквівалентно еноксапарину натрію 40 мг;
6000 анти-Ха МО/0,6 мл, що еквівалентно еноксапарину натрію 60 мг;
8000 анти-Ха МО/0,8 мл, що еквівалентно еноксапарину натрію 80 мг;
Цей лікарський засіб загалом не рекомендованийу таких випадках:
Підвищена чутливість до еноксапарину, гепарину або його похідних, у тому числі інших низькомолекулярних гепаринів.
Наявність в анамнезі тяжкої гепарин-індукованої тромбоцитопенії (ГІТ) типу ІІ, що була спричинена нефракційним гепарином або низькомолекулярним гепарином (див. розділ «Особливості застосування»).
Кровотеча або схильність до кровотечі, пов’язана з порушенням гемостазу (можливим винятком із цього протипоказання може бути дисеміноване внутрішньосудинне згортання крові, якщо воно не пов’язане з гепаринотерапією (див. розділ «Особливості застосування»).
Органічні ураження, які можуть спричинити кровотечу.
Активна клінічно значуща кровотеча.
Крім того, цей препарат зазвичай не рекомендується призначати у профілактичних дозах пацієнтам у віці від 65 років у комбінації з такими лікарськими засобами (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»):
1. Ацетилсаліцилова кислота у знеболювальних, жарознижувальних та протизапальних дозах.
2. Нестероїдні протизапальні препарати (НПЗП) (системне застосування).
3. Декстран 40 (парентеральне застосування).
Для доз 2000 анти-Ха МО/ 0,2 мл, що еквівалентно еноксапарину натрію 20 мг;
4000 анти-Ха МО/0,4 мл, що еквівалентно еноксапарину натрію 40 мг;
Цей лікарський засібзазвичай не рекомендується застосовувати:
- пацієнтам з тяжкою нирковою недостатністю (кліренс креатиніну, розрахований за формулою Кокрофта, 30 мл/хв, див. розділ «Особливості застосування»);
- упродовж перших 24 годин після внутрішньомозкового крововиливу.
Для доз 6000 анти-Ха МО/0,6 мл, що еквівалентно еноксапарину натрію 60 мг;
8000 анти-Ха МО/0,8 мл, що еквівалентно еноксапарину натрію 80 мг;
Цей лікарський засіб загалом не рекомендованийу таких випадках:
Внутрішньомозковий крововилив.
Активна виразка шлунка або дванадцятипалої кишки.
Через відсутність відповідних даних препарат не застосовують пацієнтам з тяжкою нирковою недостатністю (кліренс креатиніну, розрахований за формулою Кокрофта, 30 мл/хв), за винятком пацієнтів, які перебувають на діалізі. Пацієнтам із тяжкою нирковою недостатністю слід призначати нефракціонований гепарин. Для проведення розрахунку за формулою Кокрофта необхідно мати дані останнього вимірювання маси тіла хворого (див. розділ «Особливості застосування»).
Спінальну або епідуральну анестезію не слід ні в якому разі застосовувати пацієнтам, які знаходяться на лікуванні низькомолекулярними гепаринами (НМГ).
Пацієнтам, які отримують гепарин для лікування, а не для профілактики, протипоказана місцева анестезія при планових хірургічних втручаннях.
Не рекомендується застосовувати цей препарат у таких випадках.
При гострому обширному ішемічному інсульті головного мозку з втратою свідомості або без. Якщо інсульт спричинено емболією, у перші 72 години після інсульту еноксапарин застосовувати не можна.
На сьогодні не визначена ефективність лікувальних доз НМГ, незалежно від причини, обширності ураження або тяжкості клінічних проявів інфаркту головного мозку.
При гострому інфекційному ендокардиті (крім деяких захворювань серця, спричинених емболією).
При нирковій недостатності легкого або помірного ступеня тяжкості (кліренс креатиніну 30-60 мл/хв).
Взаємодія з іншими лікарськими засобами та інші види взаємодій.
Певні лікарські засоби або терапевтичні класи препаратів можуть сприяти розвитку гіперкаліємії: солі калію, калійзберігаючі діуретики, інгібітори ангіотензинперетворювального ферменту, інгібітори рецепторів ангіотензину ІІ, НПЗП, гепарини (низькомолекулярний або нефракційний), циклоспорин, такролімус та триметоприм.
Розвиток гіперкаліємії може залежати від того, чи має пацієнт пов’язані з нею фактори ризику. Ризик виникнення гіперкаліємії зростає, якщо вищевказані лікарські засоби застосовувати одночасно.
Пацієнти літнього віку (від 65 років).
Небажані комбінації
З ацетилсаліциловою кислотоюу знеболювальних, жарознижувальних та протизапальних дозах(і за аналогією інші саліцилати). Збільшується ризик кровотечі (пригнічення функції тромбоцитів та ураження слизової оболонки шлунково-кишкового тракту під дією саліцилатів). Слід застосовувати жарознижувальні знеболювальні засоби, що не належать до саліцилатів (наприклад парацетамол).
З НПЗП, включаючи кеторолак (системне застосування).Збільшується ризик кровотечі (пригнічення функції тромбоцитів та ураження слизової оболонки шлунково-кишкового тракту під дією НПЗП). Якщо неможливо уникнути одночасного застосування, слід проводити ретельний клінічний нагляд.
З декстраном 40 (парентеральне застосування).Підвищений ризик розвитку кровотечі (пригнічення декстраном 40 функції тромбоцитів).
З іншими тромболітиками (наприклад, альтеплазою, ретеплазою, стрептокіназою, тенектеплазою, урокіназою) та антикоагулянтами.
Комбінації, що потребують вжиття запобіжних заходів .
З пероральними антикоагулянтами.Посилення антикоагулянтного ефекту. При заміні гепарину пероральним антикоагулянтом слід посилити клінічний нагляд.
Комбінації, які слід враховувати .
З інгібіторами агрегації тромбоцитів (крім ацетилсаліцилової кислоти у знеболювальних, жарознижувальних та протизапальних дозах), такими як абсиксимаб, ацетилсаліцилова кислотав антиагрегантних дозах при кардіологічних та неврологічних показаннях,берапрост, клопідогрель, ептифібатид, ілопрост, тиклопідин, тирофібан:збільшується ризик кровотечі.
З обережністю слід застосовувати еноксапарин натрію з системними кортикостероїдами.
Пацієнти віком до 65 років.
Комбінації, які слід враховувати.Комбіноване застосування препаратів, які впливають на гемостаз, може збільшити ризик виникнення кровотечі. Тому, незалежно від віку пацієнтів, слід враховувати (а отже, проводити тривалий клінічний нагляд та, можливо, лабораторне обстеження) ефекти, що виникають при одночасному застосуванні НМГ у профілактичних дозах із такими лікарськими засобами: пероральні антикоагулянти, інгібітори агрегації тромбоцитів (абсиксимаб, НПЗП, ацетилсаліцилова кислота у будь-яких дозах, клопідогрель, ептифібатид, ілопрост, тиклопідин, тирофібан) та тромболітичні препарати.
Особливості застосування.
Препарат не дозволяється вводити внутрішньом’язово.
Хоча концентрації різних НМГ визначаються у міжнародних одиницях (МО) анти-Ха активності, їх ефективність залежить не тільки від їх анти-Ха активності. Небезпечно заміняти один режим дозування НМГ на інший або на інший синтетичний полісахарид, оскільки кожен режим було обґрунтовано специфічними клінічними дослідженнями. Отже, при застосуванні кожного препарату слід дотримуватися особливої обережності та виконувати спеціальні інструкції щодо застосування.
Запобіжні заходи при застосуванні.
Ризик виникнення кровотечі. Необхідно дотримуватись рекомендованих режимів дозування (дози та тривалість лікування). Невиконання цих рекомендацій може спричинити розвиток кровотечі, зокрема у пацієнтів з груп підвищеного ризику (пацієнтів літнього віку, пацієнтів з нирковою недостатністю).
Випадки тяжких кровотеч були зареєстровані у пацієнтів літнього віку, зокрема через зниження функції нирок, що виникає з віком; у пацієнтів з нирковою недостатністю; у пацієнтів з масою тіла нижче 40 кг; при лікуванні, тривалість якого перевищила рекомендовану середню тривалість 10 діб; при недотриманні терапевтичних рекомендацій (зокрема тих, що стосуються тривалості лікування та корегування дози відповідно до маси тіла при лікуванні); при одночасному застосуванні з препаратами, які підвищують ризик розвитку кровотечі (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
У будь-якому випадку пацієнти літнього віку та/або пацієнти з нирковою недостатністю, а також пацієнти, лікування яких триває більше 10 діб, повинні знаходитись під спеціальним наглядом.
В окремих випадках кількісне визначення анти-Ха активності може бути корисним для виявлення накопичення препарату (див. розділ «Особливості застосування»).
Ризик ГІТ. Завжди слід припускати можливість розвитку ГІТ та терміново визначати рівень тромбоцитів (див. розділ «Особливості застосування») при розвитку у пацієнта, який отримує НМГ (у лікувальних або профілактичних дозах) наступних тромботичних ускладнень:
- загострення тромбозу, лікування якого проводиться;
- флебіт;
- легеневий емболізм;
- гостра ішемія нижніх кінцівок;
- інфаркт міокарда або ішемічний інсульт.
Механічні протези клапанів серця.
Застосування еноксапарину для профілактики тромбоемболічних ускладнень у пацієнтів з механічними протезами клапанів серця окремо не вивчалось. Однак декілька окремих випадків тромбозу було зареєстровано у пацієнтів з механічними протезами клапанів серця, які отримували еноксапарин для профілактики тромбоемболічних ускладнень.
Вагітність. У клінічному дослідженні з участю вагітних жінок з механічними протезами клапанів серця, які отримували еноксапарин у дозі 100 анти-Ха МО еноксапарину/кг два рази на добу для зменшення ризику тромбоемболічних ускладнень, у двох з восьми вагітних розвився тромбоз, що спричинив обструкцію клапана, яка призвела до загибелі жінки та плода. Окремі випадки тромбозу механічного клапана серця у вагітних жінок, які отримували еноксапарин для профілактики тромбоемболічних ускладнень, було також зареєстровано під час післяреєстраційного нагляду за препаратом. Отже, у таких пацієнтів ризик тромбоемболічних ускладнень підвищений.
Медична профілактика.
Профілактичне лікування виправдано у разі гострої інфекції або ревматичного захворювання, тільки якщо є хоча б один з таких факторів ризику венозної тромбоемболії:
- вік від 75 років;
- захворювання на рак;
- венозна тромбоемболія в анамнезі;
- ожиріння;
- лікування гормонами;
- серцева недостатність;
- хронічна дихальна недостатність.
Дуже обмежений досвід застосування з метою профілактики пацієнтам віком від 80 років з масою тіла менше 40 кг.
Застереження при застосуванні.
Кровотеча. Як і у разі застосування інших антикоагулянтів, можливе виникнення кровотечі (див. розділ «Побічні реакції»). При розвитку кровотечі слід дослідити її причину та призначити відповідне лікування.
Функція нирок.Перед початком лікування НМГ слід оцінити функцію нирок, зокрема у пацієнтів віком від 75 років, шляхом визначення кліренсу креатиніну (КК) за формулою Кокрофта, використовуючи дані останнього вимірювання маси тіла:
- для пацієнтів чоловічої статі: КК = (140-вік)×маса тіла/(0,814 × креатинін в сироватці крові), де вік виражено у роках, маса тіла - у кілограмах, а креатинін в сироватці - у мкмоль/л;
- для жінок цю формулу коригують шляхом множення результату на 0,85.
Якщо сироватковий креатинін виражено в мг/мл, значення показника слід помножити на коефіцієнт 8,8.
Застосування НМГ у лікувальних дозах протипоказано пацієнтам з діагностованою тяжкою нирковою недостатністю (КК − приблизно 30 мл/хв) (див. розділ «Протипоказання»).
Пацієнти з ожирінням. Пацієнти з ожирінням мають підвищений ризик виникнення тромбоемболії. Безпека та ефективність профілактичних доз для пацієнтів з ожирінням (індекс маси тіла > 30 кг/м2) не були повністю визначені і немає рекомендацій щодо корекції дози для цих пацієнтів. Ці пацієнти повинні перебувати під ретельним наглядом щодо ознак і симптомів тромбоемболії.
Лабораторні показники.
Контроль рівня тромбоцитів у пацієнтів, які застосовують НМГ та мають ризик ГІТ(наприклад ГІТ ІІ типу).
НМГ можуть спричинити розвиток ГІТ II типу - серйозної імуноопосередкованої тромбоцитопенії, яка може призвести до артеріальних або венозних тромбоемболічних подій, що можуть бути небезпечними для життя або погіршувати функціональний прогноз для пацієнтів (див. розділ «Побічні реакції»). Для своєчасного виявлення ГІТ за пацієнтами необхідно здійснювати відповідний нагляд.
Пацієнти, які перенесли оперативне втручання або нещодавно отримали травму (протягом 3 місяців). Незалежно від того, призначають препарат з метою лікування чи профілактики, в усіх пацієнтів необхідно систематично проводити лабораторні дослідження, оскільки частота ГІТ становить > 0,1 % або навіть > 1 % у хірургії та травматології. Ці дослідження мають включати визначення кількості тромбоцитів:
- перед призначенням НМГ або не пізніше ніж через 24 години після початку терапії препаратом;
- потім двічі на тиждень протягом одного місяця (період максимального ризику);
- у подальшому у разі тривалого лікування − один раз на тиждень до припинення лікування.
Пацієнти з іншими станами, відмінними від оперативного втручання або нещодавньої травми (протягом 3 місяців).Незалежно від того, призначають препарат з метою лікування чи профілактики, необхідні систематичні лабораторні дослідження згідно з тими ж принципами, що застосовуються в хірургії і травматології (див. вище), у пацієнтів:
- які раніше отримували нефракціонований гепарин (НФГ) або НМГ в останні 6 місяців, враховуючи, що частота ГІТ становить > 0,1 % або навіть > 1 %;
- які мають значущі супутні захворювання, враховуючи потенційну тяжкість ГІТ у таких пацієнтів.
В інших випадках, з огляду на більш низьку частоту розвитку ГІТ (< 0,1 %), моніторинг кількості тромбоцитів може бути обмежений такими заходами:
- одноразовий контроль кількості тромбоцитів на початку лікування або не пізніше ніж через 24 години після початку лікування;
- контроль кількості тромбоцитів у разі наявності клінічних симптомів, що вказують на ГІТ (будь-який новий епізод артеріальної та/або венозної тромбоемболії, будь-яке болісне ураження шкіри в місці ін’єкції, будь-які алергічні або анафілактичні симптоми на тлі лікування). Пацієнтів необхідно поінформувати про можливість виникнення таких симптомів і про необхідність повідомляти про них лікарю.
Слід запідозрити виникнення ГІТ, якщо вміст тромбоцитів нижче 150 000/мм3 (або 150 г/ л) та/або якщо спостерігається відносне зменшення кількості тромбоцитів на 30−50 % порівняно з кількістю тромбоцитів перед початком лікування. ГІТ розвивається переважно з 5-ої по 21-у добу після початку лікування гепарином (з максимальною частотою розвитку приблизно через 10 діб). Однак у пацієнтів із ГІТ в анамнезі це ускладнення може виникнути значно раніше. Поодинокі випадки спостерігалися також і після 21-ї доби лікування. У зв’язку з цим слід докладати систематичних зусиль для виявлення пацієнтів з таким анамнезом шляхом детального опитування перед початком лікування. В усіх випадках виникнення ГІТ єневідкладним станом і вимагає консультації зі спеціалістом. Будь-яке значне зменшення кількості тромбоцитів (на 30−50 % порівняно із початковими показниками) є попереджувальним сигналом, навіть якщо показники не досягли критичного рівня. Якщо спостерігається зниження кількості тромбоцитів, то в усіх випадках необхідно вжити таких заходів:
1. Негайно визначити кількість тромбоцитів для підтвердження отриманих результатів.
2.Відмінити терапію гепарином, якщо цей аналіз підтверджує зниження кількості тромбоцитів або навіть вказує на його посилення та якщо іншої очевидної причини цього не виявлено. Для проведенняin vitro тесту на агрегацію тромбоцитів та імунологічного дослідження зразок необхідно помістити у пробірку з цитратним розчином. Однак за таких умов невідкладні заходи, яких необхідно вжити, не повинні ґрунтуватися на результатахin vitro тесту на агрегацію тромбоцитів або імунологічного дослідження, оскільки існує лише декілька спеціалізованих лабораторій, які можуть проводити такі тести у звичному порядку, а їх результати можна отримати в найкращому разі лише через декілька годин. Проте такі дослідження є необхідними, тому що вони можуть допомогти діагностувати це ускладнення, оскільки ризик виникнення тромбозу при продовженні лікування гепарином у таких випадках є дуже високим.
3. Проводити профілактику або лікування тромботичних ускладнень, пов’язаних з ГІТ. Якщо продовження антикоагулянтної терапії є дуже важливим, гепарин слід замінити антитромботичним засобом, який належить до іншої групи препаратів, наприклад данапароїдом натрію або лепірудином, який призначають у лікувальних або профілактичних дозах індивідуально для кожного пацієнта. Заміну пероральними антикоагулянтами можна проводити тільки після того, як кількість тромбоцитів повернеться до норми, оскільки існує ризик загострення тромбозу при застосуванні пероральних антикоагулянтів.
Заміна гепарину пероральними антикоагулянтами.
Слід посилити клінічний нагляд та підвищити частоту виконання лабораторних аналізів (протромбіновий час, виражений як міжнародне нормалізоване співвідношення (МНС)) для контролю за ефективністю пероральних антикоагулянтів.
У зв’язку з існуванням проміжку часу для досягнення максимального ефекту перорального антикоагулянту, лікування гепарином у постійній дозі потрібно продовжувати протягом часу, необхідного для підтримання МНС у межах бажаного терапевтичного інтервалу при визначенні у двох послідовних аналізах.
Моніторинг антифактор-Ха активності. Оскільки більшість клінічних досліджень, які продемонстрували ефективність НМГ, були проведені із застосуванням дози, розрахованої відповідно до маси тіла пацієнта, та без спеціального моніторингу лабораторних показників, значення лабораторного контролю для оцінки ефективності НМГ не встановлене. Однак моніторинг анти-Ха активності може бути корисним для контролю ризику виникнення кровотечі у певних клінічних ситуаціях, які часто пов’язані із ризиком передозування.
Ці ситуації переважно стосуютьсялікувальних показань до застосування НМГ та пов’язані з дозами, що вводяться пацієнтам із:
- легкою та помірною нирковою недостатністю (КК − приблизно 30-60 мл/хв, розрахований за формулою Кокрофта). Оскільки НМГ виводиться переважно з сечею, на відміну від стандартного нефракціонованого гепарину, будь-яка ниркова недостатність може стати причиною відносного передозування. Тяжка ниркова недостатність є протипоказанням до застосування НМГ у лікувальних дозах (див. розділ «Протипоказання»);
- надмірно великою або надмірно низькою масою тіла (схуднення або навіть кахексія, ожиріння);
- кровотечею нез’ясованої етіології.
На відміну від цього, моніторинг лабораторних показників не рекомендований при застосуванні профілактичних доз, якщо НМГ застосовуються відповідно до терапевтичних рекомендацій (зокрема щодо тривалості лікування) або під час проведення гемодіалізу.
Для виявлення можливої кумуляції гепарину після багаторазового введення препарату рекомендується у разі необхідності проводити забір крові для аналізу на піку активності (ґрунтуючись на наявних даних), тобто приблизно через 4 години після проведення третьої ін’єкції, якщо лікарський засіб вводиться у вигляді підшкірних ін’єкцій 2 рази на добу.
Питання про проведення повторних досліджень анти-Ха активності з метою визначення рівнів гепарину в крові, наприклад, через кожні 2-3 доби, слід вирішувати індивідуально, залежно від результатів попереднього дослідження. Слід також розглянути можливість коригування дози НМГ.
Визначено, що анти-Ха активність змінюється залежно від виду кожного НМГ та кожного режиму дозування.
За інформацією, що ґрунтується на існуючих даних, середнє значення (± стандартне відхилення), яке спостерігалося через 4 години після сьомої ін’єкції еноксапарину у дозі100 анти-Ха МО/кг/на ін'єкцію два рази на добу, становило 1,20 ± 0,17 анти-Ха МО/мл.
Це середнє значення спостерігалося у клінічних дослідженнях, під час яких вивчення анти-Ха активності проводилося хромогенним (амідолітичним) методом.
Контроль АЧТЧ.
Деякі НМГ спричиняють помірне підвищення АЧТЧ. Оскільки клінічне значення цього тесту не встановлено, то немає необхідності використовувати цей тест для моніторингу лікування.
Спінальна/епідуральна анестезія у хворих, які отримують профілактичне лікування НМГ.Ніколи не можна проводити епідуральну або спінальну анестезію пацієнтам, які отримують терапію НМГ у лікувальних дозах.
Як і у випадку застосування інших антикоагулянтів, при застосуванні НМГ під час проведення спінальної/епідуральної анестезії повідомлялося про рідкісні випадки спінальних гематом, що спричиняли тривалий або постійний параліч.
Ризик розвитку спінальної гематоми є вищим у випадку епідуральної анестезії, яка проводиться із застосуванням катетера, ніж у випадку спінальної анестезії.
Ризик виникнення цих рідкісних подій може зростати при тривалому використанні епідуральних катетерів у післяопераційний періодабо у пацієнтів, які у минулому перенесли хірургічні втручання на хребті або мали деформацію хребта (наприклад анкілозуючий спондилоартрит).
Встановлення або видалення катетера найкраще здійснювати тоді, коли антикоагулянтний ефект еноксапарину є низьким. Проте точний час досягнення достатнього низького антикоагулянтного ефекту у кожного окремого пацієнта невідомий.
Якщо передопераційне застосування НМГ є необхідним (пацієнти, які довгий час прикуті до ліжка, травма) і якщо користь від місцевої/регіональної спінальної анестезії або люмбальної пункції була ретельно зважена, пацієнтам, які отримали перед операцією ін’єкцію НМГ, можна проводити таку анестезію за умови, що між ін’єкцією гепарину і спінальною анестезією пройшло не менше 12 годин. Проте, оскільки анти-Xa активність може зберігатися і після цього 12-годинного інтервалу часу, все ще може виникнути нейроаксіальна гематома. У пацієнтів з КК < 30 мл/хв може бути доцільно витримувати принаймні 24 години між ін’єкцією гепарину та спінальною анестезією.
Рекомендується проводити ретельний моніторинг неврологічного статусу пацієнта, пам’ятаючи про ризик виникнення спінальної гематоми.
Майже в усіх хворих через 6−8 годин після анестезії або після видалення катетера можна розпочинати профілактичну терапію НМГ з контролем неврологічного стану.
Слід дотримуватись особливої обережності при застосуванні препарату одночасно з іншими лікарськими засобами, які впливають на гемостаз (особливо нестероїдними протизапальними засобами, аспірином).
Стани, які супроводжуються особливим ризиком.
Контроль за проведенням лікування необхідно підвищити у таких випадках:
- печінкова недостатність;
- наявність в анамнезі шлунково-кишкових виразок або інших органічних уражень, які можуть спричинити кровотечу;
- судинне хоріоретинальне захворювання;
- післяопераційний період після хірургічного втручання на головному або спинному мозку;
- люмбальна пункція: слід враховувати ризик інтраспінальної кровотечі і, по можливості, відкладати її проведення якнайдовше;
- одночасне застосування з лікарськими засобами, які впливають на гемостаз (див. розділ «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Перкутанні процедури реваскуляризації коронарних артерій.
Для мінімізації ризику розвитку кровотечі у пацієнтів, яким проводиться ПКВ з метою лікування нестабільної стенокардії, інфаркту міокарда без зубця Q або гострого інфаркту міокарда з підйомом сегмента ST, слід точно дотримуватися рекомендованих проміжків часу між введенням доз еноксапарину. Важливе значення має досягнення гемостазу у місці пункції після проведення ПКВ. У випадку застосування спеціальних засобів для закриття судини (гемостатичних пристроїв) слід негайно видалити провідник. У разі ручної компресії провідник необхідно видалити через 6 годин після останнього підшкірного/внутрішньовенного введення еноксапарину. При продовженні лікування із застосуванням еноксапарину наступну ін’єкцію слід робити не раніше ніж через 6-8 годин після видалення провідника. Необхідно спостерігати за місцем пункції шкіри при ПКВ для виявлення будь-яких ознак кровотечі або гематоми.
Гострий генералізований екзантематозний пустульоз
Повідомлялося про гострий генералізований екзантематозний пустульоз (ГГЕП) з невідомою частотою у зв'язку з лікуванням еноксапарином. Під час призначення пацієнтам слід повідомити про ознаки та симптоми та уважно стежити за шкірними реакціями. При появі ознак і симптомів, що свідчать про ці реакції, еноксапарин слід негайно відмінити та розглянути альтернативне лікування (за потреби).
Застосування у період вагітності або годування груддю.
Для доз 2000 анти-Ха МО/0,2 мл, що еквівалентно еноксапарину натрію 20 мг;
4000 анти-Ха МО/0,4 мл, що еквівалентно еноксапарину натрію 40 мг.
Вагітність.
У дослідженнях на тваринах не було виявлено жодних доказів тератогенного впливу еноксапарину. У разі відсутності будь-якого тератогенного впливу у тварин, не очікується цього ефекту у людини.
Речовини, які сприяють виникненню вад розвитку у людини, виявилися тератогенними у тварин під час добре проведених досліджень у двох видів.
Профілактичне лікування у І триместрі вагітності.
Недостатньо клінічних даних для оцінки можливих тератогенних або фетотоксичних ефектів еноксапарину при його профілактичному застосування у І триместрі вагітності або як лікувальної терапії протягом всієї вагітності.
Тому як застереження еноксапарин небажано призначати з профілактичною метою впродовж першого триместру вагітності.
Якщо планується проводити епідуральну анестезію, то профілактичне застосування гепарину слід припинити, якщо є така можливість, щонайменше за 12 годин до проведення анестезії.
Профілактичне лікування у ІІ та ІІІ триместрах вагітності.
З тих обмежених даних, які існують на даний час щодо клінічного застосування еноксапарину в ІІ та ІІІ триместрах вагітності, невідомо про будь-які тератогенні або фетотоксичні ефекти еноксапарину у профілактичних дозах. Проте, щоб оцінити його вплив за цих умов, слід провести додаткові дослідження.
Таким чином, застосування профілактичних доз еноксапарину у ІІ та ІІІ триместрах слід розглядати лише у разі необхідності.
Якщо планується проводити епідуральну анестезію, то профілактичне застосування гепарину слід припинити, якщо є така можливість, щонайменше за 12 годин до проведення анестезії.
Період годування груддю.Оскільки гастроінтестинальна абсорбція у новонароджених є неможливою в принципі, жінкам, які годують дитину груддю, лікування еноксапарином не протипоказане.
Для доз 6000 анти-Ха МО/0,6 мл, що еквівалентно еноксапарину натрію 60 мг;
8000 анти-Ха МО/0,8 мл, що еквівалентно еноксапарину натрію 80 мг.
Вагітність. У дослідженнях на тваринах не було виявлено жодних доказів тератогенного впливу еноксапарину, тому не очікується цього ефекту у людини.
Відповідних клінічних даних недостатньо для оцінки можливих тератогенних або фетотоксичних ефектів еноксапарину при його введенні у лікувальних дозах у період вагітності.
Тому як запобіжний захід еноксапарин в лікувальних дозах переважно не слід призначати у період вагітності.
У жодному разі не можна проводити спінальну або епідуральну анестезію у пацієнтів, які отримують терапію НМГ у лікувальних дозах.
Годування груддю.Оскільки гастроінтестинальна абсорбція у новонароджених є малоймовірною, жінкам, які годують груддю, лікування еноксапарином не протипоказане.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами.
Прийом препарату не впливає на здатність керувати автотранспортним засобом та працювати з іншими механізмами. Проте слід бути обережними з огляду на можливі побічні реакції (див. розділ «Побічні реакції»).
Спосіб застосування та дози.
1 мг (0,01 мл) еноксапарину натрію відповідає приблизно 100 одиницям активності анти-Ха МО. Фленокс® слід вводити підшкірно при профілактичному і лікувальному застосуванні, за винятком таких випадків:
- застосування препарату для антикоагуляції у практиці гемодіалізу;
- лікування пацієнтів з інфарктом міокарда з елевацією сегмента ST, яким необхідне внутрішньовенне болюсне введення.
Фленокс®не дозволяється вводити внутрішньом’язово. Препарат рекомендований до застосування тільки дорослим пацієнтам.
Техніка підшкірного введення. Заповнені виробником шприци готові до безпосереднього використання. У разі необхідності дозу препарату Фленокс® можна відкоригувати залежно від маси тіла пацієнта. Для цього у разі необхідності перед проведенням ін’єкції зі шприца потрібно видалити зайву кількість препарату. Якщо у видаленні зайвої кількості препарату потреби немає, то з метою уникнення втрати препаратуусувати повітряні пухирці зі шприца перед ін’єкцією не потрібно.
Підшкірну ін’єкцію препарату Фленокс® краще виконувати, коли пацієнт перебуває у лежачому положенні. Вводити препарат у підшкірно-жирову тканину передньобічної або задньобічної поверхні черевної стінки почергово у правий та лівий бік, використовуючи різні місця для кожної ін’єкції. Голку потрібно ввести на всю довжину вертикально у товщу складки шкіри, а не під кутом до неї, утвореною між великим та вказівним пальцями. Складку шкіри потрібно утримувати протягом усього введення ін’єкції. Не можна терти місце ін’єкції після введення.
Техніка внутрішньовенного (болюсного) введення/застосування препарату Фленокс® для лікування гострого інфаркту міокарда з підйомом сегмента ST.
Лікування розпочинати із внутрішньовенної болюсної ін’єкції, після чого негайно проводити підшкірну ін’єкцію. Для проведення внутрішньовенного болюсу із заповненого виробником градуйованого шприца з препаратом Фленокс®, який містить 40 мг (0,4 мл; 4000 анти-Ха MO), 60 мг (0,6 мл; 6000 анти-Ха MO) або 80 мг (0,8 мл; 8000 анти-Ха MO), необхідно видалити зайву кількість препарату, щоб у шприці залишилася доза 30 мг (0,3 мл; 3000 анти-Ха MO).
Цю дозу препарату Фленокс® вводити у трубку системи для внутрішньовенного введення розчинів. Не допускається змішування або одночасне введення препарату з іншими лікарськими засобами. Для видалення залишків інших лікарських засобів, а отже, і для попередження їх змішування з препаратом Фленокс® перед проведенням внутрішньовенної болюсної ін’єкції препарату Фленокс® та після нього систему необхідно промити достатньою кількістю 0,9 % розчину натрію хлориду або 5 % розчину глюкози. Фленокс® можна безпечно вводити у 0,9 % розчині натрію хлориду або у 5 % розчині глюкози.
В умовах стаціонару препарат Фленокс® можна застосовувати для:
- отримання дози 1 мг/кг (100 анти-Ха МО/кг) для першої підшкірної ін’єкції, яку необхідно провести слідом за внутрішньовенною болюсною ін’єкцією, а також для подальших доз 1 мг/кг (100 анти-Ха МО/кг), які необхідно вводити підшкірно кожні 12 годин;
- отримання дози 0,3 мг/кг (30 анти-Ха МО/кг) для внутрішньовенного болюсного введення хворим, яким проводять подальшу коронарну ангіопластику.
Упродовж усього періоду лікування слід регулярно контролювати кількість тромбоцитів, оскільки існує ризик виникнення гепарин-індукованої тромбоцитопенії (ГІТ).
Профілактика венозної тромбоемболії при хірургічних втручаннях, які супроводжуються помірним та високим тромбогенним ризиком.
Як загальне правило, ці рекомендації стосуються хірургічних процедур, які проводяться під загальною анестезією.
У разі спінальної та епідуральної анестезії слід зважити користь від введення еноксапарину перед операцією та теоретично підвищений ризик розвитку спінальної гематоми (див. розділ «Особливості застосування»).
•Схема введення.Препарат Фленокс® вводити 1 раз на добу підшкірно.
• Доза.Дозу слід визначати на основі оцінки ризику, для конкретного пацієнта і виду хірургічного втручання.
Хірургічні операції, які супроводжуються помірним ризиком тромбоутворення.
Під час операцій, які супроводжуються помірним ризиком тромбоутворення, та у пацієнтів, які не мають високого ризику тромбоемболії, ефективна профілактика забезпечується щоденним введенням препарату Фленокс®у дозі 20 мг (0,2 мл; 2000 анти-Ха МО). Режим дозування, що був досліджений, передбачає введення першої ін’єкції за 2 години до операції.
Хірургічні операції, які супроводжуються високим ризиком тромбоутворення.
Операції на кульшовому, колінному суглобах.
Доза препарату Фленокс®становить 40 мг (0,4 мл; 4000 анти-Ха) один раз на добу.
Режим дозування, що був досліджений, передбачає введення першої ін’єкції 4000 анти-Xa МО (повна доза) за 12 годин перед операцією або першої ін’єкції 2000 анти-Xa МО (половина дози) за 2 години перед операцією.
Інші ситуації.
Якщо існує підвищений ризик венозної тромбоемболії, пов’язаний з видом хірургічного втручання (особливо при онкологічних операціях) та/або з анамнезом пацієнта (якщо були випадки венозної тромбоемболії), слід вводити таку саму профілактичну дозу, як і при ортопедичних операціях з високим ризиком, таких як операції на кульшовому, колінному суглобах.
•Тривалість лікування.
Лікування НМГ слід продовжувати разом із накладанням звичайних компресійних еластичних пов’язок на ноги, поки пацієнт зможе повноцінно та активно пересуватися:
- при загальних операційних втручаннях лікування НМГ має тривати менше 10 днів, поки у пацієнта існує ризик розвитку венозної тромбоемболії (див. розділ «Особливості застосування»);
- була встановлена терапевтична користь профілактичного лікування еноксапарином у дозі 4000 анти-Xa МО/добу протягом 4-5 тижнів після операції на колінному суглобі;
- якщо пацієнт все ще має ризик венозної тромбоемболії після рекомендованої тривалості лікування, слід розглянути можливість продовження профілактичної терапії, зокрема введення пероральних антикоагулянтів.
Слід зазначити, що клінічна користь довготривалого лікування низькомолекулярними гепаринами або пероральними антикоагулянтами не досліджувалася.
Профілактика тромбозу глибоких вен у пацієнтів, які перебувають на постільному режимі у зв’язку з гострими терапевтичними захворюваннями.
Рекомендована доза препарату Фленокс® становить 40 мг (0,4 мл; 4000 анти-Ха МО) 1 раз на добу підшкірно. Фленокс® призначати щонайменше на 6 днів, тривалість лікування - не більше 14 днів. Якщо ризик виникнення венозної тромбоемболії все ще зберігається, слід проводити тривале профілактичне лікування із застосуванням пероральних антикоагулянтів.
Профілактика тромбоутворення в екстракорпоральному контурі кровообігу під час проведення гемодіалізу.
Препарат вводити внутрішньосудинно (у внутрішньоартеріальний катетер або діалізний контур).
Для хворих, які отримують повторні сеанси гемодіалізу, профілактика зсідання крові в екстраренальній системі очищення крові забезпечується введенням початкової дози 100 анти-Xa МО/кг у внутрішньоартеріальний катетер або діалізний контур на початку сеансу.
Ця доза вводиться внутрішньосудинно у вигляді одноразової болюсної ін’єкції. Антикоагулянтного ефекту цієї дози, як правило, достатньо для проведення сеансу гемодіалізу, що триває 4 години або менше. Вона може потім коригуватися з урахуванням значних індивідуальних коливань відповіді.
Максимальна рекомендована доза становить 100 анти-Xa МО/кг.
Для гемодіалізних пацієнтів з групи високого ризику кровотечі (особливо при діалізі у пре- і постоперативному періоді) або з активною кровотечею під час сеансів діалізу можна застосовувати дозу 50 анти-Xa МО/кг (подвійний судинний доступ) або 75 анти-Xa МО/кг (один судинний доступ).
Лікування діагностованого тромбозу глибоких вен, який супроводжується або не супроводжується тромбоемболією легеневої артерії та не має тяжких клінічних симптомів.
Будь-яку підозру на виникнення тромбозу глибоких вен слід негайно підтвердити за допомогою відповідних методів дослідження.
Дозування.
Фленокс® призначати підшкірно 2 рази на добу у дозі 100 анти-Ха МО/кг кожні 12 годин.
У пацієнтів з масою тіла більше 100 кг та менше 40 кг корекція дози НМГ не вивчалася. НМГ може бути менш ефективним у пацієнтів з масою тіла більше 100 кг та призводити до підвищеного ризику виникнення кровотечі у пацієнтів з масою тіла менше 40 кг. Тому необхідно ретельно контролювати клінічний стан цих пацієнтів.
Тривалість лікування тромбозу глибоких вен.
При лікуванні із застосуванням низькомолекулярного гепарину слід якомога швидше перейти на прийом пероральних антикоагулянтів, якщо протипоказання відсутні. Тривалість лікування НМГ не повинна перевищувати 10 днів, включаючи час необхідний для досягнення рівноважного стану пероральними коагулянтами, за винятком тих випадків, коли важко досягти рівноважного стану. Тому терапію пероральними антикоагулянтами слід розпочинати якомога раніше.
Лікування нестабільної стенокардії та інфаркту міокарда без зубця Q.
Рекомендована разова доза препарату Фленокс® становить 1 мг/кг (100 анти-Ха МО/кг) підшкірно через кожні 12 годин; одночасно призначати ацетилсаліцилову кислоту перорально (рекомендовані дози: від 75 до 325 мг перорально після початкової навантажувальної дози 160 мг).
Тривалість лікування - щонайменше 2-8 діб, до клінічної стабілізації стану пацієнта.
Лікування гострого інфаркту міокарда з підйомом сегмента ST у комбінації з тромболітичним засобом у хворих, яким проводять подальшу коронарну ангіопластику, а також у хворих, яким цю процедуру не проводять.
Початкову внутрішньовенну болюсну ін’єкцію препарату Фленокс® проводити у дозі 30 мг (0,3 мл; 3000 анти-Ха МО). Після чого підшкірно вводити 1 мг/кг (100 анти-Ха МО/кг) протягом 15 хвилин, потім кожні 12 годин (для перших двох підшкірних ін’єкцій максимальна сумарна доза становить 10000 анти-Ха МО).
Першу дозу препарату Фленокс® слід вводити у будь-який час за 15 хвилин до або через 30 хвилин після початку тромболітичної терапії.
Рекомендована тривалість лікування становить 8 днів або поки пацієнта не випишуть зі стаціонару, якщо госпіталізація триває менше 8 днів.
Супутня терапія: після появи симптомів слід якнайшвидше розпочинати прийом ацетилсаліцилової кислоти і продовжувати у дозі 75-325 мг на день протягом не менше 30 днів, якщо не показано інакше.
Хворі, яким проводять коронарну ангіопластику:
- якщо з часу останнього підшкірного введення препарату Фленокс® до роздування балона пройшло менше 8 годин, додаткове введення препарату не потрібне;
- якщо з часу останнього підшкірного введення препарату Фленокс® до роздування балона пройшло більше 8 годин, необхідно провести внутрішньовенну болюсну ін’єкцію 0,3 мг/кг (30 анти-Ха МО/кг) препарату Фленокс®. Для забезпечення точності об’ємів, що вводяться ін’єкційно, рекомендується розвести препарат до 300 анти-Ха МО/мл (0,3 мл (3000 анти- Ха МО) розвести у 10 мл розчинника (0,9 % розчину натрію хлориду або 5 % розчину глюкози)) (див. таблицю).
Об’єми, необхідні для ін’єкційного введення, коли розведення здійснюється для хворих, яким проводиться коронарна ангіопластика
Маса тіла, кг | Необхідна доза, анти-Ха МО | Об’єм, необхідний для ін’єкційного введення, при розведенні до 300 МО/мл (тобто 0,3 мл (3000 анти-Ха МО) препарату Фленокс®, розведені у 10 мл розчинника)), мл |
45 | 1350 | 4,5 |
50 | 1500 | 5 |
55 | 1650 | 5,5 |
60 | 1800 | 6 |
65 | 1950 | 6,5 |
70 | 2100 | 7 |
75 | 2250 | 7,5 |
80 | 2400 | 8 |
85 | 2550 | 8,5 |
90 | 2700 | 9 |
95 | 2850 | 9,5 |
100 | 3000 | 10 |
Пацієнтам віком від 75 років, які знаходяться на лікуванні з приводу гострого інфаркту міокарда з підйомом сегмента ST, початкову внутрішньовенну болюсну ін’єкцію не проводять. Кожні 12 годин їм слід підшкірно вводити дозу 0,75 мг/кг (75 анти-Ха МО/кг) (тільки для перших двох ін’єкцій максимальна сумарна доза становить 75 мг (7500 анти-Ха МО)).
Інструкції щодо самостійного ведення препарату Фленокс® у шприц-дозі
1. Вимити руки водою з милом. Висушити їх.
2. Обрати ділянку у правій або лівій частині живота. Ця ділянка має бути віддалена (у напрямку до боків) від пупка щонайменше на 5 сантиметрів.
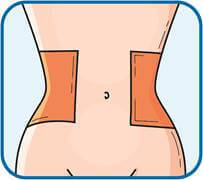
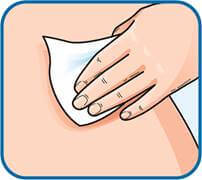
3. Змінювати місце ін’єкції, виконуючи її поперемінно у праву та ліву сторони живота, залежно від того, в яку сторону було зроблено ін’єкцію минулого разу. Очистити місце ін’єкції тампоном зі спиртом.
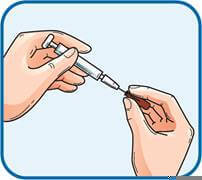
4. Обережно зняти ковпачок з голки, приєднаної до шприца з препаратом Фленокс®. Викинути цей ковпачок. Шприц є попередньо наповненим і готовим до використання.НЕ натискати на поршень до виконання ін’єкції щоб позбутися бульбашок повітря. Це може призвести до втрати лікарського засобу. Після того, як знято ковпачок, не допускати, щоб голка торкалася чого-небудь. Це необхідно для забезпечення того, що голка буде залишатися чистою (стерильною).
5. Тримати шприц у руці так, як олівець при письмі, вказівним і великим пальцями іншої руки злегка відтягнути очищену ділянку живота, щоб утворилася складка. Обов’язковоутримувати шкірну складку протягом усієї ін’єкції.
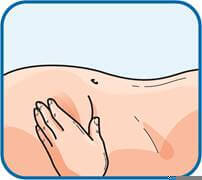
6. Тримати шприц таким чином, щоб голка була спрямована донизу (вертикально під кутом 90°). Ввести голку у шкірну складку на повну довжину.
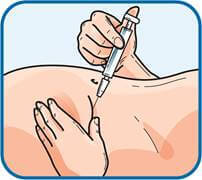
7. Натиснути поршень шприца пальцем. Обов’язково утримувати шкірну складку протягом усієї ін’єкції.
8. Ввести голку, витягуючи її прямо у зворотному напрямку. Тепер можна відпустити складку шкіри. Одразу ж викинути шприц у найближчий контейнер для гострих предметів.
Для уникнення утворення синця не розтирати місце ін’єкції після введення препарату.
Діти.
Через відсутність відповідних даних не рекомендується застосовувати НМГ у педіатричній практиці.
Передозування.
Випадкове передозування при підшкірному введенні значних доз НМГ може призвести до виникнення геморагічних ускладнень.
У разі кровотечі деяких пацієнтів можна лікувати протаміну сульфатом, при цьому слід враховувати, що:
- ефективність протаміну сульфату значно нижча, ніж ефективність, що спостерігається при передозуванні нефракційного гепарину;
- перед застосуванням протаміну сульфату через можливість виникнення небажаних явищ (зокрема анафілактичного шоку) слід ретельно зважити співвідношення користь/ризик.
Нейтралізацію еноксапарину здійснювати шляхом повільного внутрішньовенного введення протаміну (сульфату або гідрохлориду).
Необхідна доза протаміну залежить від:
- введеної дози гепарину (100 антигепаринових одиниць протаміну нейтралізують активність 100 анти-Ха МО НМГ), якщо з моменту введення еноксапарину натрію пройшло не більше 8 годин;
- часу, що минув після ін’єкції гепарину:
- якщо еноксапарин натрію вводили більше 8 годин тому або якщо необхідно ввести другу дозу протаміну, можна провести інфузію 50 антигепаринових одиниць протаміну на 100 анти-Ха МО еноксапарину;
- якщо еноксапарин вводили більше 12 годин тому, то необхідності у введені протаміну немає.
Ці рекомендації призначені для пацієнтів з нормальною нирковою функцією, які отримують повторні дози препарату.
Проте повністю нейтралізувати анти-Ха активність еноксапарину неможливо.
Крім того, нейтралізація може мати тимчасовий характер внаслідок особливостей фармакокінетики всмоктування НМГ, в результаті чого може виникнути необхідність розподілити загальну розраховану дозу протаміну на декілька ін’єкцій (2−4), які вводити протягом 24 годин.
При потраплянні низькомолекулярного гепарину у шлунок, навіть у великих кількостях, тяжкі ускладнення є малоймовірними (таких випадків зареєстровано не було) внаслідок незначного всмоктування лікарського засобу у шлунку та кишечнику.
Побічні реакції.
Побічні реакції, що спостерігалися в клінічних дослідженнях і про які повідомляли у постмаркетинговому періоді, детально описані нижче.
За частотою виникнення побічні реакції розподілено на такі категорії: дуже часто (≥1/10); часто (від ≥1/100 до <1/10); нечасто (від ≥1/1000 до <1/100); рідко (від ≥1/10000 до <1/1000); дуже рідко (<1/10000); частота невідома (неможливо оцінити за наявними даними).
Досвід застосування у клінічних дослідженнях. Застосування еноксапарину вивчали серед більш ніж 15 000 пацієнтів в рамках клінічних досліджень.
Кількість пацієнтів, показання та схеми дозування детально зазначені у таблиці 1.
Таблиця 1
| Профілактика венозних тромбоем-болій у хірургічних пацієнтів | Профілактика ТГВ у терапевтичних пацієнтів під час гострого захворювання | Лікування ТГВ з емболією легеневої артерії або без неї | Лікування нестабільної стенокардії або інфаркту міокарда без зубця Q | Лікування інфаркту міокарда з елевацією сегмента ST |
Кількість пацієнтів, які отримували еноксапарин | 1776 | 1169 | 559 | 1578 | 10 176 |
Схема дозування | 40 мг підшкірно один раз на добу | 40 мг підшкірно один раз на добу | 1 мг/кг підшкірно кожні 12 годин або 1,5 мг/кг підшкірно один раз на добу | 1 мг/кг підшкірно кожні 12 годин | 30 мг внутрішньовенно болюсно, після чого по 1 мг/кг підшкірно кожні 12 годин |
Кровотечі.У клінічних дослідженнях кровотечі були побічними реакціями, про які повідомляли найчастіше. Сюди відносяться і серйозні кровотечі, про які повідомляли у 4,2 % пацієнтів (хірургічного профілю). Деякі з цих випадків були летальними.
Геморагічні ускладнення розцінювались як серйозні у таких випадках:
- якщо кровотеча спричинила значущу клінічну подію;
- якщо кровотеча супроводжувалася зниженням рівня гемоглобіну на ≥ 2 г/дл або трансфузією 2 або більше одиниць препаратів крові;
- ретроперитонеальні та внутрішньочерепні крововиливи завжди розцінювали як серйозні.
Як і у випадку з іншими антикоагулянтами, кровотеча може виникати у разі наявності супутніх факторів ризику, таких як:
- органічні ураження зі схильністю до кровотечі;
- інвазивні процедури або одночасне застосування лікарських засобів, які впливають на гемостаз (див. розділи «Особливості застосування» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»).
Таблиця 2
Категорії «Система-Орган-Клас» за класифіка-цією MedDRA | Профілак-тика ТГВ у хірургічних пацієнтів | Профілактика ТГВ у терапевтичних пацієнтів | Консерватив-не лікування ТГВ з емболією легеневої артерії або без неї | Нестабільна стенокардія / інфаркт міокарда без елевації сегмента ST | Інфаркт міокарда з елевацією сегмента ST |
З боку судин | Дуже часто: геморагічні явища*
Рідко: ретропери-тонеальний крововилив | Часто: геморагічні явища* | Дуже часто: геморагічні явища*
Нечасто: внутрішньо-черепний крововилив, ретроперито-неальний крововилив | Часто: геморагічні явища*
Рідко: ретроперито-неальний крововилив | Часто: геморагічні явища*
Нечасто: внутріш-ньочерепний крововилив, ретропери-тонеальний крововилив |
* Наприклад: гематома, екхімоз (не в місці ін’єкції), гематома рани, гематурія, носова кровотеча та шлунково-кишкова кровотеча.
Таблиця 3
Тромбоцитопенія та тромбоцитоз.
Категорії «Система-Орган-Клас» за класифіка-цією MedDRA | Профілактика ТГВ у хірургічних пацієнтів | Профілактика ТГВ у терапевтичних пацієнтів | Консервативне лікування ТГВ з емболією легеневої артерії або без неї | Нестабільна стенокардія / інфаркт міокарда без елевації сегмента ST | Інфаркт міокарда з елевацією сегмента ST |
З боку крові та лімфатичної системи | Дуже часто: тромбоцитоз*
Часто: тромбоцито-пенія | Нечасто: тромбоцито-пенія | Дуже часто: тромбоцитоз*
Часто: тромбоцито-пенія | Нечасто: тромбоцито-пенія | Часто: тромбо-цитоз*, тромбо-цитопенія
Дуже рідко: імуно-алергічна тромбо-цитопенія |
* Кількість тромбоцитів > 400 Г/л
Інші небажані реакції, які спостерігались у клінічних дослідженнях, представлені нижче, незалежно від показання до застосування препарату, та класифіковані за категоріями «Система-Орган-Клас», частотою виникнення та в порядку зменшення їхньої серйозності.
Таблиця 4
Категорії «Система-Орган-Клас» за класифікацією MedDRA | Небажані ефекти (при застосуванні препарату при всіх показаннях) |
З боку імунної системи | Часто: алергічна реакція, що в деяких випадках може призвести до припинення лікування препаратом Рідко: анафілактична або анафілактоїдна реакція |
З боку печінки та жовчовивідних шляхів | Дуже часто: підвищення рівнів печінкових ферментів (головним чином рівнів трансаміназ більш ніж у 3 рази вище верхньої межі норми) |
З боку шкіри та підшкірної клітковини | Часто: кропив’янка, свербіння, еритема Нечасто: бульозний дерматит Частота невідома: гострий генералізований екзантематозний пустульоз (ГГЕП) |
Загальні розлади та реакції у місці введення препарату | Часто: гематома у місці ін’єкції*, біль у місці ін’єкції, інша реакція у місці ін’єкції (наприклад, набряк, крововилив, алергічна реакція, запалення, утворення вузликів, інші реакції). Нечасто: некроз шкіри у місці ін’єкції, що може розвинутись після появи пурпури чи інфільтративних болючих еритематозних бляшок, що вимагає негайного припинення лікування препаратом; місцеве подразнення. |
Зміни при лабораторних та інструментальних дослідженнях | Рідко: гіперкаліємія |
* Ризик підвищується у разі недотримання рекомендованої техніки здійснення ін’єкції або використання невідповідного ін’єкційного матеріалу.
Досвід застосування у постмаркетинговий період.
Побічні реакції, наведені нижче, були виявлені у постреєстраційний період.
Оскільки про ці реакції повідомляли добровільно, їх частота оцінюється як невідома (не може бути оцінена за наявними даними).
З боку імунної системи.Шкірні або системні алергічні реакції (анафілактичні або анафілактоїдні реакції, в тому числі шок), які у окремих випадках можуть призводити до відміни препарату.
З боку нервової системи. Головний біль.
З боку судин.Були зареєстровані випадки значних геморагічних ускладнень, деякі з них були летальними. Нечастими побічними реакціями були внутрішньочерепні та ретроперитонеальні крововиливи. Також реєструвалися випадки геморагічних ускладнень (кровотечі), таких як гематома, екхімози у місцях, відмінних від місця ін’єкції, гематома рани, гематурія, носова кровотеча та шлунково-кишкова кровотеча.
Геморагічні епізоди пов’язані головним чином з:
- супутніми факторами ризику: органічними ураженнями, при яких існує імовірність виникнення кровотечі, та деякими комбінаціями лікарських засобів (див. розділи «Протипоказання» та «Взаємодія з іншими лікарськими засобами та інші види взаємодій»), віком, нирковою недостатністю, низькою масою тіла;
- недотриманням терапевтичних рекомендацій,а саме: тривалості лікування та корекції дози відповідно до маси тіла (див. розділ «Особливості застосування»).
Зареєстровано рідкі випадки виникнення спінальної гематоми після застосування НМГ під час спінальної анестезії, аналгезії або епідуральної анестезії.
Ці побічні явища призводили до неврологічних розладів різного ступеня тяжкості, в тому числі до тривалого або постійного паралічу (див. розділ «Особливості застосування»).
З боку крові та лімфатичної системи. Повідомлялося про виникненнятромбоцитопенії. Існує два її типи.
Тип І, тобто найбільш поширені випадки, зазвичай помірного ступеня тяжкості (більше 100000/мм3), з’являються на ранніх етапах (до 5 доби) і не потребують припинення лікування.
Тип ІІ, тобто рідкісні випадки тяжкої імуноалергічної тромбоцитопенії (ГІТ). Частота виникнення досліджена недостатньо (див. розділ «Особливості застосування»).
Можливе безсимптомне оборотне підвищення рівня тромбоцитів.
Геморагічна анемія.
Є дані щодо виникнення гіпереозинофілії, як ізольовано, так і на тлі шкірних реакцій, яка зникала після припинення лікування.
З боку шкіри та підшкірної клітковини. Зареєстровано випадки васкуліту внаслідок гіперчутливості шкіри. Були зареєстровані випадкинекрозу шкіри,переважно у місці ін’єкції. Їм може передувати поява пурпури або інфільтрованих та болісних еритематозних плям. У таких випадках слід негайно припинити терапію. Повідомлялося про гострий генералізований екзантематозний пустульоз (ГГЕП) у зв’язку з лікуванням еноксапарином (див. розділ «Особливості застосування»).
Алопеція.
З боку печінки та жовчовивідних шляхів. Повідомлялося про випадки гепатоцелюлярного або холестатичного ураження печінки.
З боку опорно-рухового апарату. Можливий розвитокостеопорозу при лікуванні протягом тривалого часу.
Загальні розлади та реакції у місці введення препарату. Після підшкірної ін’єкції можливе утворення гематоми у місці введення препарату. Були зареєстровані випадки болю у місці ін’єкції, інших реакцій, включаючи подразнення, набряк у місці ін’єкції, гіперчутливість, запалення та утворення вузликів. Цей ризик підвищується при недотриманні рекомендованої техніки проведення ін'єкцій та при використанні невідповідного ін’єкційного матеріалу. У результаті запальної реакції можуть виникнути вузлики у місці ін’єкції, які зникають протягом декількох днів. Їх поява не потребує припинення лікування.
Нефракціоновані гепарини можуть спричиняти гіпоальдостеронізм, який призводить до збільшення плазмового рівня калію. Рідко може виникнути клінічно значуща гіперкаліємія, особливо у пацієнтів з хронічною нирковою недостатністю та цукровим діабетом.
Повідомлялося про випадки транзиторного підвищення рівнів трансаміназ.
Зареєстровано декілька випадківгіперкаліємії.
Термін придатності.
2 роки.
Не застосовувати препарат після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання.
Зберігати в оригінальній упаковці при температурі не вище 25 °C. Не заморожувати.
Зберігати в недоступному для дітей місці.
Несумісність. Не змішувати з іншими лікарськими засобами.
Упаковка.
По 0,2 мл, 0,4 мл, 0,6 мл або 0,8 мл у шприці.
По 1 шприцу в блістері. По 1, 2 або 10 блістерів (з препаратом активністю 2000 анти-Ха МО, 4000 анти-Ха МО, 6000 анти-Ха МО) і по 1 або 2 блістери (з препаратом активністю 8000 анти-Ха МО), вкладених в пачку.
По 2 шприца в блістері. По 1 або 5 блістерів (з препаратом активністю 2000 анти-Ха МО, 4000 анти-Ха МО, 6000 анти-Ха МО) і по 1 блістеру (з препаратом активністю 8000 анти- Ха МО), вкладених в пачку із картону або по 25 блістерів у коробці з картону.
Категорія відпуску. За рецептом.
Виробник. АТ «Фармак».
Місцезнаходження виробника та його адреса місця провадження діяльності.
Україна, 04080, м. Київ, вул. Кирилівська, 74.




